NF2 Therapie
Bei Neurofibromatose Typ 2 handelt es sich - wie generell bei Neurofibromatosen - um eine chronisch verlaufende Erkrankung, deren Therapie auf die Behandlung einzelner Symptome beschränkt ist.
Die Therapiemöglichkeiten werden im Folgenden vorgestellt. Auch die Erforschung rein medizinischer Therapieansätze rückt mehr und mehr in den Vordergrund.
Sobald neue Symptome auftreten, die man nicht einordnen kann, sollte man den Arzt aufsuchen. Zwar ist die Krankheit noch nicht heilbar, sie lässt sich jedoch durch die rechtzeitige Behandlung in ihrem Verlauf positiv beeinflussen.

Technische Hilfsmittel bei Ertaubung
Schon vor mehr 200 Jahren hat der italienische Physiker Alessandro Giuseppe Antonio Anastasio Volta überrascht bemerkt, dass schwacher elektrischer Strom, angelegt an seinen eigenen, wassergefüllten äußeren Gehörgang, eine Geräuschempfindung auslöste. Er vermutete schon damals ganz richtig, dass der Effekt auf einer elektrischen Stimulation von Nerven beruhen muss.
Hören durch elektrischen Strom
Mehr als einhundert Jahre später - 1925 - haben amerikanische Radioingenieure Volta's Experiment in abgewandelter Form mit Reizelektroden in der Nähe des Ohrs wiederholt und diesem Effekt einen Namen gegeben: "elektrophones Hören".
Wirklich beflügelt wurde die Erforschung des Hörens aber 1930 durch eine zufällige Entdeckung amerikanischer Physiologen. Sie hatten eine Elektrode direkt an den Hörnerv einer Katze angelegt. Das Tier befand sich in einem schalldichten Raum zusammen mit zwei Forschern, die miteinander sprachen. Die Elektrode war über ein Kabel mit einem Lautsprecher im Nebenraum verbunden, um die elektrischen Entladungen des Nervs dort hörbar zu machen. Plötzlich konnte man über den Lautsprecher etwas hören, was sich wie menschliche Sprache anhörte. Bei der genaueren Untersuchung stellte sich heraus, dass das Hörsystem, ganz ähnlich wie ein Telefon, Schallwellen in elektrische Signale umwandeln und diese Signale - so genannte "Mikrofonpotenziale" - über den Hörnerv weiterleiten kann. In den 30er Jahren hatte das Telefon sich schon in weiten Teilen der Gesellschaft durchgesetzt. Die Vermutung, das menschliche Hören könnte ähnlich funktionieren wie ein Telefon, war ein starker Anreiz für die weitere Forschung auf diesem Gebiet, auch wenn sie sich später als unrichtig herausstellen sollte.
Die erste wissenschaftliche Publikation über eine gezielte elektrische Stimulation des Hörnervs des Menschen unter der Fragestellung, ob dadurch möglicherweise das Hörvermögen wiederhergestellt werden kann, entstand 1957. Französische Wissenschaftler hatten nach einer radikalen Tumoroperation mit Entfernung des Innenohrs durch elektrische Reize Geräusche auslösen können, die der Patient wahrnahm, als würde sich ein Roulette drehen.
Entwicklung des ABI
Eine vollständige Ertaubung durch Verlust beider Hörnerven bedeutet für den Menschen einen besonders tief greifenden Einschnitt in die Kommunikation mit seiner Umwelt.
Die Wiederherstellung des Hörvermögens durch auditorische Implantate ist der größte praktische Erfolg, den die Neuroprothetik bisher im Bereich der Sinnesfunktionen erreichen konnte. Ist der Hörnerv auf beiden Seiten zerstört, kann eine elektronische Hörhilfe nur funktionieren, wenn die Elektrode an einen Punkt verlegt wird, der in der Hörbahn des Nervensystems weiter zentral liegt als in der Hörschnecke (wie dies beim zuvor beschriebenen Cochlea Implantat der Fall ist).
Konventionelle Hörgeräte und cochleäre Implantate sind wirkungslos, weil die Überleitung der Signale auf den Hirnstamm auf natürlichem Wege unmöglich geworden ist. Die nächste Station der Hörbahn 'hinter' dem Hörnerv ist der Hirnstamm. So sind aus den Cochlea-Implantaten die auditorischen Hirnstammimplantate (ABI) entstanden.
Das erste ABI wurde 1979 in Los Angeles eingesetzt. Es war für heutige Verhältnisse primitiv und bestand aus zwei kugelförmigen Elektroden, die am Stumpf des Hörnervs andockten. Mit diesem einkanaligen ABI war die Patientin in der Lage, die Stimmen von drei männlichen Sprechern und verschiedene Geräusche sowie einzelne Vokale zu unterscheiden. Freie Umgangssprache konnte sie nicht verstehen, aber ihre Fähigkeit, von den Lippen abzulesen, hatte sich deutlich verbessert.
Wegen eines Kabelbruchs musste das Implantat zwei Jahre später gewechselt werden. Es wurde eine neu entwickelte Elektrode eingesetzt, die diesmal nur auf die Oberflächen des Hirnstamms gelegt wurde. Mit dieser eingesetzten Elektrode - wieder nur mit zwei Kontakten - kann die Patientin seit mehr als einem Vierteljahrhundert Höreindrücke empfangen, ohne dass sich die Qualität dieser Eindrücke verschlechtert hat. Sie selbst sagt: "lch hatte das erste ABI lange genug, um zu wissen, dass es mir hilft und irgendetwas ist einfach besser als nichts."
Unter dem Verdacht auf ein Verrutschen der Elektrode vom Hörkern weg und bei nachweislichem Bruch eines Zuleitungskabels 6 Wochen nach der Implantation wurde die Stimulation für 2 Jahre ausgesetzt. 1981 wurde das erste Implantat gegen eine Elektrode, bei der zwei Kontaktstreifen auf einem Dacronnetz aufgebracht waren ausgetauscht.
Seit mehr als 21 Jahren empfängt die Patientin darüber gleichbleibend und komplikationsfrei Höreindrücke - zehn bis zwölf Stunden am Tag. Innerhalb der ersten 3-4 Jahre traten immer noch neue Hörempfindungen auf, danach nicht mehr. Erst fast drei Jahre nach dieser erfolgreichen Revision bei der ersten Patientin wurde erneut ein ABI implantiert.
Ab Mitte der 80er-Jahre konnte man auf durch die Haut gehende Steckverbindungen verzichten - eine wesentliche Infektionsquelle war gebannt, sodass jetzt auch die amerikanische Zulassungsbehörde FDA (Food and Drug Administration) die Zulassung für erste klinische Serienuntersuchungen mit dem ABI erteilte. 1987 begann man mit der Entwicklung eines Mehrkanal-Stimulationssystems. Die ab 1988 durchgeführten detaillierten Messungen der Wahrnehmungskapazität mit dem ABI zeigten, dass die Patienten, die in den dargebotenen akustischen Signalen enthaltene zeitliche Information in normaler Weise aufnehmen und verarbeiten konnten. Inzwischen wurde die Anzahl der Elektroden, welche den Hörkern am Hirnstamm stimulieren können, verzehnfacht. Aktuelle Implantate verwenden 21 aktivierbare Elektroden. Weltweit wurden mehr als 6oo Patienten mit Hirnstammimplantaten versorgt.
Neben der Weiterentwicklung der Sprachprozessor-Technik, welche ihre Impulse durch den überragenden, weltweiten Erfolg des Cochlear Implants erhielt, wurde die Elektrodenentwicklung vorangetrieben. Das europäische Konzept hatte von Beginn an gezielt auf die Verwendung von Mehrkanal-Implantaten gesetzt, um möglichst viele Tonhöhen separat zu stimulieren. In der klinischen Praxis konnte dann auch tatsächlich ein Tonhöhenabfall von innen nach außen an den über dem Hörkern eingebrachten Elektroden beobachtet werden.
Obwohl zeitliche Reizauflösung, Dynamik und Lautstärkecharakteristik dem Cochlea-Implantat sehr ähnlich sind, blieben die Ergebnisse vor Allem mit Blick auf das Verständnis von Sprache mit dem ABI trotz ausgefeilter Sprachprozessortechnik und Einbindung vieler Elektroden hinter den Erfolgen mit dem CI zurück. Auffallend ist vor allem der individuelle Faktor: Manche Patienten verstehen mit dem ABI sehr gut, andere schlecht. Im Durchschnitt entspricht die Qualität des durch ein ABI erreichbaren Höreindrucks derzeit dem eines einkanaligen CI. Das Lippenlesen wird für mehr als die Hälfte der ABI-Patienten bereits in den ersten Wochen nach Implantation deutlich leichter. Dieser Effekt nimmt später noch weiter zu, so dass die meisten Patienten ihr Implantat permanent einsetzen. Umgebungsgeräusche können gehört, von Sprache unterschieden und oft richtig eingeordnet werden.
Diese Unterschiede haben verschiedene Ursachen. Eine davon dürfte in der sehr komplexen Form und Lage des Hörkerns, also der biologischen Struktur, die das ABI stimulieren soll, liegen. Der Kern hat zwei Anteile:
In den vorderen (gelb in Abb. 1 + 2) ziehen die meisten Fasern des Hörnervs. Die Oberflächen-Elektroden reizen aber vor allem den hinteren Anteil (rot in Abb. 1 + 2), weil dieser flacher unter der Oberfläche liegt. Wie beim CI müssen nach dem Einsetzen des ABIs Reizstärken, Reizdauer und Elektrodenkombinationen individuell angepasst werden. Aber welche Qualität kann man denn nun wirklich von einem solchen Implantat erwarten? Was kann man damit hören, was nicht? Um das zu wissen, sollte man sich am besten die bisherigen Ergebnisse weltweit anschauen.
Ebenfalls in den 50er Jahren stimulierte Wilder Penfield, einer der Schüler des deutschen Neurochirurgen Otfried Foerster, in Montreal während einer Operation elektrisch die Hirnrinde des Schläfenlappens und konnte dadurch bei den in Lokalanästhesie befindlichen Patienten Höreindrücke auslösen.
Alle diese Untersuchungen ließen eine gemeinsame Schlussfolgerung zu: Es ist möglich, durch elektrische Stimulation an verschiedenen Stellen der Hörbahn, also des Sinneskanals, der vom Innenohr bis zur Großhirnrinde verläuft, Höreindrücke auszulösen.
Die Überbrückung des defekten Mittelohrs - Cochlea Implantate
1961 entwickelten James Doyle und William House Implantate zur elektrischen Stimulation der Cochlea in den USA. Mit diesen "Cochlear Implantats" (CI) konnten die Patienten Umgebungsgeräusche hören und den Rhythmus von Musik und Sprache erkennen. Die ersten CIs waren nicht gewebeverträglich und mussten nach einigen Wochen wieder entfernt werden.
1966 implantierte eine Arbeitsgruppe um F. Blair Simmons an der Stanford Universität eine Elektrode in die oberste Windung der Hörschnecke und stimulierte damit direkt elektrisch den Hörnerven. Simmons war jedoch enttäuscht, dass der Patient Sprache nicht verstehen konnte und bezweifelte schließlich selbst die Möglichkeit, durch elektrische Stimulation des Hörnervs jemals eine sinnvolle Kommunikationshilfe für Ertaubte zu schaffen.
Wissenschaftlicher Pessimismus zog ein und die Entwicklung stagnierte. Doch schon 5 Jahre später gab es neue Erfolge bei einer kleineren Serie von ertaubten Patienten zu berichten und das von William House 1973 beschriebene Ein-Kanal-Implantat (3M/House) war das erste CI, was bei mehreren Hundert Patienten Anwendung fand.
1981 berichteten zwei Arbeitsgruppen aus den USA und Australien unabhängig voneinander zum ersten Mal über Patienten, die durch CI ein Sprachverständnis erlangt hatten - das CI war eine etablierte klinische Methode zur Wiederherstellung des Hörvermögens und damit die erste echte "Neuroprothese" geworden.
Vom CI zum ABI
Mit dem CI war eine Technologie geschaffen worden, die es erlaubte, Schallwellen in elektrische Impulse umzuwandeln und diese Impulse mit einem programmierbaren Mikroprozessor so zu verändern, dass sie nach Übertragung auf den intakten Hörnerven einen Höreindruck bis hin zum Verständnis von Sprache vermitteln konnten. Was aber, wenn beide Hörnerven zerstört sind? Kann man das Hören wirklich ebenso durch elektrische Stimulation an anderen Stellen der menschlichen Hörbahn wiederherstellen?
Als die HNO-Chirurgen House und Hitselberger am 24.05.1979 in den Hörkern am Hirnstamm ihrer Patientin nach Entfernung eines Tumors des Hör- und Gleichgewichtsnerven zwei kleine Kugelelektroden einsetzten, gaben sie sich keiner Illusion hin. Sie hatten bis dato am House Ear Institute in Los Angeles zwar gute Erfahrungen mit CIs gesammelt, aber bei der 46-Jährigen Patientin waren durch Neurofibromatose Typ 2, beide Hörnerven seit etwa 6 Monaten komplett zerstört. Ein CI konnte nicht helfen, da Nervenfasern zur Weiterleitung seiner Impulse zum Hirnstamm nicht mehr vorhanden waren. Dr. House und Dr. Histelberger schlugen vor, eine Elektrode auf den Stumpf des Hörnervs am Hirnstamm zu platzieren, um den Hörkern ("Nucleus cochlearis") direkt zu stimulieren. Damit war die Patientin in der Lage, die Stimmen von drei männlichen Sprechern und verschiedene Geräusche sowie einzelne Vokale zu unterscheiden. Umgangssprache konnte sie nicht verstehen, aber ihre Fähigkeit, von den Lippen abzulesen, hatte sich deutlich verbessert. Sie berichtet: „Ich konnte Betten hoch und runter federn hören. Ich hörte Wasser ins Waschbecken laufen, die Toilettenspülung, die Absätze der Schwestern auf dem Boden klicken und so weiter. Ich verbrachte einen Monat im Krankenhaus. Als ich nach Hause kam, konnte ich Flugzeuge hören, die Mikrowelle, Hundegebell, das Läuten des Telefons.
Neuere Entwicklungen - das AMI
Leider ist die Hörverbesserung durch ein ABI bei NF2-Patienten nur relativ gering. Die Annahme, dass bei NF2-Patienten zusätzliche durch Hirntumoren bedingte Schäden des Nucleus cochlearis vorliegen, die ggf. durch die chirurgische Entfernung der Tumoren noch verstärkt wurden, führte zu der Überlegung, dass die elektrische Stimulation der zentralen Hörbahn proximal zum tumorgeschädigten Hirnstamm eventuell zu einem besseren Sprachverstehen bei NF2-Patienten führen könnte. Hierzu bietet sich der Colliculus inferior an, der aufgrund seiner regelhaften tonotopen Organisation für eine frequenzselektive Stimulation geeignet ist. Seit 2006 wird als Alternative zu einem CI oder ABI nun eine neu entwickelte zentral auditorische Neuroprothese getestet, das Auditory Midbrain Implant (AMI). Das Auditorische Mittelhirnimplantat ist eine zentral auditorische Prothese zur Wiederherstellung des Hörvermögens bei Patienten mit neuraler Taubheit
Das AMI setzt noch zwei Stationen höher als das ABI in der Hörbahn an. Aufgrund seiner gut erforschten tonotopen Organisation und seiner zentralen Stellung im Bereich der Hörbahn wurde der Colliculus inferior (IC) als Implantationsort gewählt. Die Elektrode des AMI ist stabförmig und besitzt 20 ringförmige Elektrodenkontakte, deren Breite und Abstand eine frequenzspezifische Reizung ermöglichen sollen.
Der Entwicklung des AMI liegt die Vermutung zugrunde, dass die Stimulation eines intakten Colliculus inferior eventuell eine bessere Alternative für die Wiederherstellung des Hörvermögens bei NF2-Patienten sein kann als die Stimulation im Bereich eines veränderten und vielleicht teilweise zerstörten Nucleus cochlearis.
Die Arbeit von Djourno und Eyries griffen amerikanische Chirurgen und Forscher auf. 1961 entwickelten der HNO-Arzt James Doyle und sein Schüler William House Implantate zur elektrischen Stimulation der Hörschnecke (Cochlea). Die implantierten Patienten konnten Umgebungsgeräusche hören und den Rhythmus von Musik und Sprache erkennen. Aufgrund von Nebenwirkungen und Fistelbildung mussten die ersten Implantate jedoch nach einigen Wochen wieder entfernt werden.
In Europa wurde jetzt durch den Otologen Fritz Zöllner in Freiburg und den Physiologen Wolf Dieter Keidel Pionierarbeit geleistet. Zöllner und Keidel antizipierten das sprachvermittelnde Multikanal-CI und skizzierten in Ihren weit vorausschauenden Arbeiten bereits 1963 im Prinzip das heute gebräuchliche Implantat.
F. Blair Simmons stimulierte 1964 anlässlich der Entfernung eines rezidivierten Kleinhirntumors intraoperativ den Hörnerv elektrisch. Dem beidseits normalhörigen Patienten waren bereits vor dem Eingriff Geräusche vorgespielt worden, wie sie durch akustische Rechteck- und Sägezahnwellen entstehen. Während der Operation wurde der Nervus cochlearis bipolar mit ähnlichen elektrischen Reizfolgen stimuliert. Der in Lokalanästhesie operierte Patient berichtete, dass er tatsächlich ähnliche Geräusche wahrnähme wie tags zuvor beim akustischen Training.
1966 implantierte die gleiche Arbeitsgruppe an der Stanford Universität eine Elektrode in direkt in die Hörschnecke eines seit Geburt tauben Patienten - die eigentliche Geburtsstunde des Cochlea Implant (CI). Simmons zeigte sich jedoch enttäuscht, dass der Patient Sprache nicht verstehen konnte und bezweifelte selbst die Möglichkeit, durch elektrische Stimulation des Hörnervs jemals eine sinnvolle Kommunikationshilfe für Ertaubte zu schaffen. Diese Meinung schien die bestehenden Vorbehalte aus dem Bereich der Grundlagenforschung zu bestätigen, dass Implantate nicht in der Lage wären die Komplexität der menschlichen Sprache zu reproduzieren. Unzureichend getestete Gewebeverträglichkeit und die Ansicht, dass die durch die Taubheit der Patienten entstandenen irreversiblen neuralen Schädigungen die Effektivität solcher Implantate auf ein Minimum reduzieren würden, verwandelten die Pioniere auf diesem Gebiet in wissenschaftliche Außenseiter.
Forschung und Entwicklung ließen sich dadurch jedoch kaum aufhalten: Michelson präsentierte 1971 die erste erfolgreiche klinische Serie mit vier Patienten bei denen ein Ein-Kanal-Implantat eingesetzt worden war.
Das von House und Urban 1973 beschriebene Ein-Kanal-Implantat (3M/House) war das erste CI, was bei mehreren Hundert Patienten Anwendung fand.
1981 berichteten sowohl Michelson und Schindler als auch Clark et al. (Melbourne) unabhängig voneinander zum ersten Mal über Patienten, die durch cochleäre Implantate ein Sprachverständnis erlangt hatten.
Für die meisten der Patienten ist das Lippenabsehen bereits in den ersten Wochen nach der Implantation deutlich besser möglich. Dieser Effekt nimmt später noch weiter zu, sodass die meisten Patienten ihr Implantat auch dauerhaft einsetzen. Alltagsgeräusche (z.B. Türklingel, vorbeifahrende Autos, Autohupen) werden gehört und von Sprache unterschieden. Sehr oft können Männer-, Frauen und Kinderstimmen gut auseinandergehalten werden. Manche Patienten können weiter in ihrem Beruf arbeiten.
Zur Wahrnehmung eindeutiger Höreindrücke ist für Patienten mit den heutigen ABIs eine geräuscharme Umgebung Voraussetzung. Längere Worte können aufgrund von Nachhall- und Echo-Effekten meist nicht verstanden werden. Ein echtes freies Sprachverständnis, d.h. das Verstehen von Wörtern und Sätzen ohne unterstützendes Lippenablesen, erhalten nur wenige - etwa 10 - 15 % - der Patienten allein durch das ABI zurück. Zeit spielt hier eine Rolle - Lerneffekte sind noch nach Jahren möglich. Die Fähigkeit, mehrsilbige Wörter (bzw. Zahlen) ohne visuelle Unterstützung zu erkennen, kann sich bei einigen Patienten noch bis zu 8 Jahre nach Implantation verbessern. Bei jungen Patienten, bei denen die Ursache des Hörverlustes eine beidseitige Anlagestörung oder eine Verletzung der Hörnerven und kein Tumor ist, sind die Ergebnisse deutlich besser.
Die Ursache dafür könnte darin liegen, dass bei ihnen der Hörkern im Hirnstamm noch nicht durch Druck, Verlagerung oder Durchblutungsstörungen vorgeschädigt ist. Aus anatomischen, technischen und physiologischen Gründen ist außerdem zu vermuten, dass durch die Stimulation mit Oberflächenelektroden am Hirnstamm nicht alle im Hörkern repräsentierten Tonhöhen erreicht werden können. Es wurden daher Tiefenelektroden - Nadeln mit einer Länge von mehreren Millimetern - zum Kontakt der tiefer gelegenen Anteile vor allem des vorderen Hörkerns (gelb in Abb. 1) entwickelt und in Los Angeles auch bei einigen Patienten eingesetzt. Die Ergebnisse wurden im Detail noch nicht veröffentlicht. Nachteile oder Blutungen durch das Einsetzen der Elektroden sind aber offenbar bisher nicht aufgetreten.
Ein echtes Sprachverständnis erhalten also nur wenige Patienten allein durch die elektro-auditorische Stimulation mit dem ABI. Patienten, die dieses Niveau erreichen, verstehen etwa 50% der Wörter in einem Satz und können sogar über Telefon kommunizieren. In einer Studie mit 60 Patienten aus Los Angeles, die sechs Monate nach Implantation untersucht wurden, lag der Anteil der Telefonnutzer bei 12%. 82% der Patienten konnten bekannte Geräusche, wie z.B. Autohupen und Türklingeln, identifizieren. 85% erreichten mit dem ABI eine Verbesserung der Kommunikation über das Lippenablesen hinaus.
Mögliche Nebenwirkungen
In der Apotheke ist klar: Ein Medikament, welches angeblich keine Nebenwirkungen hat, hat mit ziemlicher Sicherheit überhaupt keine Wirkungen. In der Neuroprothetik, also dem Teil der Chirurgie, der sich mit der Wiederherstellung verloren gegangener oder fehlerhafter Funktionen beschäftigt, werden Nebenwirkungen durch die elektrische Stimulation außerhalb der Zielstrukturen hervorgerufen. Zu den Strukturen, die in der Nähe des Hörkerns liegen und die daher fehlstimuliert werden könnten, zählen die motorischen und sensiblen Gesichtsnerven (Fazialis und Trigeminus), die sensiblen Bahnen für Druckempfindung, Vibrationsempfinden, Raumsinnempfindung, Berührungssensibilität vor allem der Beine und der Gleichgewichtskern. Es kann also bei Anschalten der entsprechenden Elektrodenkombinationen z.B. zu Vibrationsempfindungen, Schwindel, Zuckungen im Bereich des Gesichts und der Schulter oder auch zu eigenartigen Empfindungen im Bereich des Gesichts kommen. Nebenwirkungen durch Stimulation der Schluck- und Stimmnerven sind zwar denkbar, meist werden diese aber schon dadurch vermieden, dass man diese Nerven schon während der Implantation einem Monitoring unterzieht, d.h. dass die Lage der Elektrode verändert wird, wenn während der Operation schon Fehlstimulationen dieser Nerven nachgewiesen werden.
Der Vorteil elektronischer lmplantate ist, dass die Behandlung solcher Fehlstimulationen ziemlich einfach ist - man kann sie im wörtlichen Sinn 'abschalten'. Nachfolgend wird man dann die entsprechenden Elektrodenkombinationen vermeiden. Bereits während der Implantation kann man durch Reizung über die ABI Elektrode elektrische Wellen ableiten, die in der Hörbahn entstehen. Damit weiß das Operationsteam schon während des Eingriffs, ob der Patient später einen Höreindruck haben wird. Es kann aber sein, dass nach dem Abschalten aller Elektroden, die eine Fehlstimulation als Nebenwirkung hervorrufen, nicht mehr genügend Kontakte übrig bleiben, um einen wirklich guten Höreindruck hervorzurufen.
Das ist eines der wesentlichsten Probleme des ABIs und seine Darstellung gehört daher auch zur Aufklärung vor der Implantation. Die dadurch entstehende Unsicherheit bei einzelnen Patienten hat immer wieder auch zu einer Verunsicherung in der öffentlichen Diskussion über das ABI geführt. Bei Fehlstimulation sowie Funktionsverlust oder Verrutschen (Migration) der Elektrode ist es erfahrenen Operateuren möglich, das Implantat noch einmal zu entfernen bzw. neu zu platzieren, ohne den Hörkern oder umliegendes Gewebe zu schädigen.
Zu den häufigen Nebenwirkungen zählen Schwindel und Missempfindungen im Bereich der Zunge, des Kopfes und des Beines. Ein Patient beschrieb bei Stimulation einer bestimmten Elektrodenkombination Vibrationsempfindungen im gesamten Körper.
Die Risiken eines ABIs entstehen fast ausnahmslos im Rahmen der Implantation selbst. Der operative Eingriff zum Einsetzen eines CIs und eines ABIs unterscheidet sich bezüglich Empfängerspule und Kabelzuleitungen eigentlich überhaupt nicht. Infektionen und Wundheilungsstörungen sind hier besonders zu erwähnen. Beide sind sehr selten geworden, seitdem die Signale vom Sprachprozessor von einem Sender auf der Haut zu einem Empfänger unter der Haut ohne eine Kabelverbindung übertragen werden (Abb.: 3). Die Sendespule wird durch einen Magneten über dem Empfänger auf der Haut hinter dem Ohr festgehalten.
Aber was kann passieren, wenn man Elektroden an den Hirnstamm bringt? Im Hirnstamm befinden sich schließlich lebenswichtige Nervenzellen für die Regulation von Atmung, Herz und Blutkreislauf. Zehn Hirnnerven - neben dem Hörnerv mit ihren wichtigen Funktionen für Augenbewegung' Gleichgewicht, Bewegung und Gefühl im Gesicht, Schlucken, Geschmack, Tränensekretion, Stimmbildung, Schulter-, Kopf- und Zungenbewegungen – haben hier ihren Ursprung. Darüber hinaus ziehen sämtliche Nervenbahnen vom und zum Groß- und Kleinhirn durch den Hirnstamm hindurch. Wie gefährlich ist eine solche Operation aber wirklich?
Kann man sie mit einer Operation im Gehirn vergleichen?
Meist werden ABIs in dem gleichen Eingriff eingesetzt, bei dem auch ein Tumor-meist ein Akustikusneurinom (= Vestibularisschwannom) - entfernt wird. Insbesondere bei großen Tumoren überwiegen die Risiken der Tumorentfernung in diesem Fall die Risiken der Implantation des ABIs bei weitem.
Betrachten wir einmal nur das Einsetzen der Elektrode selbst: Im Gegensatz zu Operationen im Gehirn - etwa zum Entfernen einer Blutung oder eines Tumors - werden dabei Gefäße nicht eröffnet oder verschlossen. Die Operateure nutzen die natürlichen Räume zwischen Kleinhirn und Hirnstamm. Dadurch werden Nervenzellen oder Nervenbahnen geschont. Die Elektrode selbst wird in einen natürlichen, mit Hirnwasser gefüllten Spaltraum - den sogenannten 'Recessus lateralis' - eingelegt. Daraus erklärt sich die auch gegenüber anderen Operationen im Schädel sehr geringe Komplikationsrate bei der Implantation.
Nachblutungen sind zwar denkbar, ihr Risiko ist aber vor allem durch die Entfernung von Tumoren im gleichen Eingriff begründet; die Elektrode selbst ist zart genug, um in ihrer Umgebung bei vorsichtiger Implantation und auch später keine Gefäße zu verletzen. Ein wesentliches Risiko besteht in einer Infektion im Schädelinneren. Weil das Implantat aus künstlichem Material besteht und Bakterien sich eher an künstlichen Materialien festsetzen als an natürlichen, ist dieses Risiko gegenüber Operationen ohne Einbringen von Fremdmaterial etwas erhöht. Alterdings erfolgt heute bei sehr vielen Kopfoperationen der Verschluss des Schädels mit Hilfe von kleinen Implantaten aus Titan, ohne dass dadurch häufiger Infektionen auftreten.
Um die Möglichkeit einer Fehlstimulation anatomischer Nachbarstrukturen des Hörkerns auszuschließen, werden heute außerdem die Gesichts-, Schluck-, Stimm- und Zungennerven sowie der Nerv für den Schulterheber- und Kopfnickermuskel während der Operation kontinuierlich überwacht. Darüber hinaus können auch die aufsteigenden Bahnen aus den Tast- und Lageempfindungssystemen des Körpers ständig überprüft werden. Die korrekte Lage des Implantates wird durch Ableitungen elektrischer Potenziale aus der intakten Hörbahn des Gehirns bestätigt.
Kann man die Elektrode wieder entfernen? Im Prinzip ist es möglich, das gesamte Implantat auch wieder zu explantieren. Die Frage ist: Wodurch könnte die Notwendigkeit dazu eintreten? Zum einen könnte ein technischer Fehler im Empfänger auftreten. In diesem Fall ist es leider bei den heutigen Implantaten noch nicht möglich, nur die Empfängerspule mit dem Magneten auszuwechseln und einfach das Zuleitungskabel zur Elektrode in den neuen Empfänger einzustecken. Man hat bisher bewusst auf eine Steck- oder auch Schraubverbindung verzichtet, um nicht eine zusätzliche Fehlerquelle einzubauen. Auch ein Kabelbruch bedeutet daher, dass das ganze Implantat gewechselt werden muss.
Einen Vorteil bieten die modernen Implantate in dieser Hinsicht - ihre Funktionsfähigkeit lässt sich von außen, also ohne einen operativen Eingriff (telemetrisch), abfragen. Verwachsungen zwischen der Hirnstammelektrode und dem Hüllgewebe des Hirnstamms (Spinnenhaut = Arachnoidea) sind zwar gewünscht, damit die Elektrode später nicht mehr verrutschen kann. Dadurch sind aber auch eine Entfernung bzw. ein Austausch der Elektrode auf ihrem Netzgeflecht aus Dakron ® mit einem erhöhten Verletzungsrisiko des Gewebes verbunden. Insbesondere könnte es sein, dass Teile des Hörkerns geschädigt und damit die Funktion des ABIs beeinträchtigt wird.
Die Erfahrung zeigt aber, dass sowohl ein Wechsel als auch eine Lagekorrektur der Elektrode möglich ist. Ebenso gibt es Erfahrungen mit der Verlagerung der Empfängerspule. Das ist möglich, ohne die zarten Zuleitungen zur Elektrode zu beschädigen, z.B. wenn es zu Entzündungen und Geschwüren an der Haut über der Spule gekommen ist. So kann die Funktion des ABIs erhalten werden, die Elektrodenlage wird dabei nicht verändert. Eine solche Komplikation ist allerdings extrem selten und wurde bisher mit den aktuellen lmplantaten auch noch nicht publiziert.
Für Träger des ABIs ist es wichtig zu wissen, dass eine Kernspintomografie (MRT) mit dem Implantat zwar möglich ist, aber in einem größeren Bereich um das Implantat durch eine Magnetverzerrung keine sinnvolle Bildinformation liefert. Man kann hier teilweise auf die hochauflösende Computertomografie ausweichen. Wird dennoch ein MRT benötigt, dann muss ein fester Druckverband um den Kopf gelegt werden, damit der bewegliche Magnet nicht aus der Empfängerspule springt oder sich verdreht. Theoretisch kann man den Magneten zur MRT-Untersuchung auch mit einem kleinen chirurgischen Eingriff kurzzeitig entfernen.
Insertionselektroden (INSEL) als Alternative?
Eine Reihe von Erkenntnissen aus der Grundlagenforschung sprechen dafür, dass durch Mikroelektroden, die in den Hirnstamm eindringen (penetrieren), eine effektivere Stimulation des Hör-Systems möglich werden könnte.
Abbildung: Schematische Darstellung der Tonhöhenrepräsentation (Tonotopie) im Nucleus cochlearis. Oberflächenelektroden (rechts) können Tonhöhenunterschiede nur durch die variable Ausprägung des elektrischen Feldes erzeugen. Mit Insertionselektroden (INSEL, links) können Regionen innerhalb des Hörkerns, die unterschiedliche Frequenzen repräsentieren, direkt stimuliert werden. (modifiziert nach Rauschecker & Shannon, Science, 2002)
Große Anteile des vorderen Hörkerns werden durch Oberflächenimplantate gar nicht erreicht. Dieser Teil des Kerngebietes erhält aber die weitaus meisten direkten Umschaltstellen vom Hörnerven. Seine Nervenzellen antworten ganz ähnlich auf Reize wie die Zellen, von denen der Hörnerv ausgeht. Der Grad ihrer Vernetzung untereinander ist noch nicht so komplex wie im hinteren Hörkern, dem Hauptzielgebiet der heutigen Oberflächenimplantate. Die Zahl der aus dem vorderen Hörkern in Richtung der höheren Hörzentren abgehenden Fasern ist etwa um den Faktor 10 größer als im hinteren Hörkern. Untersuchungen mit einer neuen Generation von Mikroelektroden aus der angewandten Forschung verstärken diese Argumente.
Mit solchen Insertionselektroden wurden insbesondere, offenbar aufgrund einer besseren Ankopplung der Stimulation an die dem Hörnerv nachgeschalteten Nervenzellen, niedrigere elektrische Reizschwellen gemessen.
Damit können möglicherweise unerwünschte Nebenwirkungen vermieden werden. Außerdem erhofft man sich eine Erweiterung des nutzbaren Intensitätsspektrums bei niedrigeren Betriebsströmen.
Penetrierende Elektroden haben im Experiment kaum Gewebeschäden im Bereich der Implantationsstelle hervorgerufen.
Problematisch ist eher die exakte Platzierung der Elektroden bei einer individuell doch deutlich variablen, durch Tumoren in diesem Bereich noch weiter veränderten Anatomie.
Ob letztlich damit eine verbesserte Spracherkennung für die Patienten möglich sein wird, können nur klinische Studien klären. Sinnvoll erscheint zunächst eine Kombination mit den bereits klinisch bewährten Oberflächenelektroden für den hinteren Hörkern.
Prof. Dr. med. Steffen Rosahl
Neurochirurgische Klinik
HELIOS Klinikum Erfurt
Nordhäuser Str. 74
D-99089 ERFURT
Phone:+49 361/781-2261
Fax: +49 361/781-2262
E-Mail: neurochirurgie.erfurt@helios-kliniken.de
Leider ist die Hörverbesserung durch ein ABI bei NF2-Patienten nur relativ gering. Die Annahme, dass bei NF2-Patienten zusätzliche durch Hirntumoren bedingte Schäden des Nucleus cochlearis vorliegen, die ggf. durch die chirurgische Entfernung der Tumoren noch verstärkt wurden, führte zu der Überlegung, dass die elektrische Stimulation der zentralen Hörbahn proximal zum tumorgeschädigten Hirnstamm eventuell zu einem besseren Sprachverstehen bei NF2-Patienten führen könnte. Hierzu bietet sich der Colliculus inferior an, der aufgrund seiner regelhaften tonotopen Organisation für eine frequenzselektive Stimulation geeignet ist. Seit 2006 wird als Alternative zu einem CI oder ABI nun eine neu entwickelte zentral auditorische Neuroprothese getestet, das Auditory Midbrain Implant (AMI). Das Auditorische Mittelhirnimplantat ist eine zentral auditorische Prothese zur Wiederherstellung des Hörvermögens bei Patienten mit neuraler Taubheit
Das AMI setzt noch zwei Stationen höher als das ABI in der Hörbahn an. Aufgrund seiner gut erforschten tonotopen Organisation und seiner zentralen Stellung im Bereich der Hörbahn wurde der Colliculus inferior (IC) als Implantationsort gewählt. Die Elektrode des AMI ist stabförmig und besitzt 20 ringförmige Elektrodenkontakte, deren Breite und Abstand eine frequenzspezifische Reizung ermöglichen sollen.
Der Entwicklung des AMI liegt die Vermutung zugrunde, dass die Stimulation eines intakten Colliculus inferior eventuell eine bessere Alternative für die Wiederherstellung des Hörvermögens bei NF2-Patienten sein kann als die Stimulation im Bereich eines veränderten und vielleicht teilweise z erstörten Nucleus cochlearis.
Der Colliculus inferior ist an der Rückseite des Mittelhirns lokalisiert. Nahezu alle absteigenden auditorischen Bahnen beider Seiten werden hier erstmals zusammengeführt. Die Elektrode des Mittelhirnimplantates („auditory midbrain implant“, AMI) ist 6,4 mm lang und weist als Elektrodenkontakte 20 Platinringe. auf. Die verwendete Elektrodentechnologie sowie der Sprachprozessor sind identisch mit dem eines konventionellen Cochleaimplantates. Die AMI-Elektrode wird in der Regel über einen mikrochirurgischen, subokzipitalen Zugang im Colliculus inferior (IC) platziert. Sie kann daher auch prinzipiell gleichzeitig mit einer Tumorentfernung implantiert werden. Eine stereotaktische Implantation wird derzeit ebenfalls erprobt.
Eine erste klinische Studie an 5 Patienten wurde ab dem Jahr 2007 durchgeführt und das AMI erstmals bei ertaubten NF2 Patienten verwendet. Trotz unterschiedlicher anatomischer Ausgangsvoraussetzungen konnte die Elektrode bei allen Patienten sicher platziert werden. Postoperativ ergaben sich weder durch die Tumorentfernung noch durch die AMI- Implantation Komplikationen.
Die Erstanpassung erfolgt vier Wochen nach Implantation. Bei den häufigsten Nebenwirkungen durch AMI-Stimulation handelt es sich um Parästhesien, die meist durch Programmierung des Systems behoben werden können. Tatsächlich traten signifikante Nebenwirkungen bisher allerdings nicht auf.
Alle Patienten können mit dem AMI Umweltgeräusche wahrnehmen, so dass wieder eine auditive Umweltorientierung möglich ist. Sie zeigen außerdem eine Verbesserung der Kommunikationsfähigkeit in Kombination mit Lippenabsehen; eine Patientin sogar ein besseres Sprachverstehen im Vergleich zum Mittelwert der NF2-Patienten mit dabei einem Hirnstammimplantat. Neben dem Geräuscherkennen finden sich also durchaus Ansätze für ein offenes Sprachverstehen. Diese ersten Ergebnisse scheinen in etwa denen bei guten ABI-Trägern zu entsprechen. Die Hörleistung hängt insgesa mt stark von der Implantatposition im Mittelhirn ab.
Bei den Patienten wurde nach Erstanpassung ein regelmäßiges Hör- und Sprachtraining durchgeführt und unterschiedliche Sprachverarbeitungsstrategien wurden erprobt. Die Hörergebnisse weisen über die Zeit eine Verbesserung auf. Insgesamt gesehen ist die Chance auf eine bessere Hörleistung durch ein AMI zwar erhöht, erfordert auf der anderen Seite jedoch flexiblere Sprachverarbeitungsstrategien. Eine auf den neu gewonnen Erkenntnissen basierende neu entwickelte Generation von AMI könnte in Zukunft allerdings möglicherweise bessere Ergebnisse im Vergleich zum ABI bei NF2-Patienten erzielen.
Allerdings sollte nicht unerwähnt bleiben, dass der technische Aufwand und das klinische Risiko mit solchen zentralen Transplantaten enorm ansteigt.

Bestrahlung
Welche NF2-Tumoren eignen sich besonders für eine Bestrahlung?
Wie beim Operieren erzielt man die besten Bestrahlungs-Ergebnisse bei kleineren, nicht voroperierten Tumoren. Bei großen Tumoren kann es die günstigste Lösung sein, in einem ersten Schritt den Tumor operativ zu verkleinern und im zweiten Schritt (nach ca. 3-6 Monaten) den Tumorrest stereotaktisch zu bestrahlen.
Am besten geeignet für stereotaktische Bestrahlung sind generell Hirntumoren. Der Kopf lässt sich gut fixieren.
Es gibt auch Gerätesysteme, mit denen man Spinaltumoren und andere Tumoren des Körpers bestrahlen kann. Zum Beispiel das Cyberknife, bei dem ein Roboter dafür sorgt, dass Bewegungen ausgeglichen werden. Auch ein nachgerüstetes bzw. bereits mit dem Roboter-Tisch ausgerüstetes Novalis kann das. In Erfurt ist es bisher noch nicht möglich.
Spinaltumoren sind aber in der Regel ohnehin besser für die Mikrochirurgie geeignet.
Bei RS und SRT, wie sie in Erfurt mit dem Novalis durchgeführt wird, sind die Ergebnisse des Hörerhalts und des Facialiserhalts bei Akustikusneurinomen in etwa denen der Mikrochirurgie vergleichbar. Der Patient entscheidet mit, was ihm lieber ist.
NF2-Tumoren verhalten sich anders als "gewöhnliche" gutartige Tumoren. Sie sind schwerer zu operieren und auch ungünstiger zu bestrahlen. Die Ergebnisse, gemessen am Funktionserhalt , sind schlechter.
Die Tumorgröße ( das Volumen des Tumors) kann nach radiochirurgischer Behandlung gleich bleiben, abnehmen und gelegentlich auch einmal zunehmen.
Bei Größenzunahme sollte man Geduld haben und nicht zu schnell operieren lassen. Die Erfahrung zeigt, dass es auch erst nach einigen Jahren doch noch zum Schrumpfen kommen kann.
Die RS und SRT (NF2 und andere zusammen) hat bei 92% der in Erfurt behandelten Fälle mit AN zur Tumorkontrolle geführt, d.h. das Wachstum der Tumoren wurde gestoppt. 8 % mussten als Rezidive gewertet werden, d.h. der Tumor ist nachgewachsen.
Ausnahme sind große AN mit starker Hirnstammkompression. Diese sollten nicht primär bestrahlt werden, weil ein Risiko besteht, dass der Druck auf den Hirnstamm zu groß wird und Lähmungen eintreten. Denn nach jeder Bestrahlung reagiert der Körper, schickt Abräumzellen zum Tumor, um die abgestorbenen Zellen abzutransportieren. Diese Reaktion ist verschieden stark, manchmal so stark, dass der Tumor nach der RS (seltener nach der SRT) anschwillt. Diese Reaktion kann bei gefährlich nah am Hirnstamm liegenden Tumoren zu Komplikationen führen.
Verteilung der Präzisionsbestrahlungs-Geräte in Deutschland:
Novalis (RS und SRT) gibt es in Berlin, Erlangen, Frankfurt/Oder, Bonn und Erfurt. Cyberknife (mit Roboterarm, einmalige Bestrahlung oder wenige Fraktionen) gibt es in München.
Gamma Knife (nur RS) gibt es in Frankfurt/Main, Krefeld, Aachen und Hannover.
Das neue Heidelberger Zentrum für Schwerionenbestrahlung ist eine andere, völlig neue Technik. Der Beschleuniger hat die Größe eines Fussballfeldes. Diese sehr aufwendige Technik ermöglicht die Bestrahlung sehr schwierig liegender Tumoren um den Hirnstamm, an der Schädelbasis. Damit hat sie für NF2-Patienten nur in Ausnahmefällen Vorteile gegenüber der SRT.
Radiochirurgie/stereotaktische Radiochirurgie wird als die Bestrahlung intracranieller Läsionen durch eine gezielte Einzelfraktion ionisierender Strahlung definiert, bei der die Anwendung herkömmlicher invasiver Chirurgie überflüssig wird.
Stereotaktische Radiotherapie ist die Behandlung intracranieller Läsionen mit Mehrfachfraktionen. Als Indikationen für die Radiochirurgie gelten v.A.: ein Vestibularisschwannom auf dem letzthörenden Ohr, voraussehbare OP-Komplikationen, Patient älter als 70 Jahre, schlechter medizinischer Allgemeinzustand, Tumor auf einem letzthörenden Ohr, beidseitige Vestibularisschwannome, Rezidiv- oder Resttumoren, Tumoren die kleiner als 3 cm sind, Begleiterkrankungen, Größenzunahme des Tumors nach Teilresektion, oder die Ablehnung einer Operation durch den Patienten. Durch die Fraktionierung der Bestrahlungstherapie konnte deren Verträglichkeit erheblich verbessert und die Komplikationsrate gesenkt werden. Die günstigste Fraktionierung ist allerdings noch nicht bekannt.

Bei einer Bestrahlung wird nicht mehr in jedem Fall eine Gewebsnekrose als oberstes therapeutisches Ziel angestrebt, sondern vielmehr ein genau definierter strahlenbiologischer Effekt, durch den der Tumor bestenfalls verkleinert wird, auch wenn das Vestibularisschwannom im Allgemeinen gut auf Bestrahlung anspricht. Die Radiochirurgie kontrolliert also hauptsächlich das Tumorwachstum, verhindert ein Fortschreiten der Symptome, das Auftreten neuer Symptome oder einer Lebensbedrohung.
Dass der Tumor dabei in seiner natürlichen Lage belassen wird, stellt für manche Patienten eine nur schwer tolerierbare Vorstellung dar. Hörerhalt ist auch bei dieser Methode nicht garantiert und die größte Gefahr besteht darin, umgebendes Gewebe zu zerstören. Umstritten sind Bestrahlungen auch wegen unerwünschter Bestrahlungsfolgen wie Hirnstammveränderungen, Entmarkung der Nerven (speziell des VII. oder des VIII. Hirnnerven) oder Langzeitfolgen wie dauerhafte Ausweitung der Liquorräume des Gehirns. Allgemein geht man allerdings von einer 20 - 30-%-igen Volumenschrumpfung des Tumors in den meisten Fällen aus und ist der Auffassung, dass eine Indikation für eine Bestrahlung häufiger gegeben ist als früher. Die größte Schwierigkeit besteht allerdings nach wie vor darin, dass es nur wenige Langzeitstudien mit Verlaufskontrollen gibt.
Grundsätzlich muss festgestellt werden, dass die vollständige Entfernung eines Tumors immer besser wäre, als durch Bestrahlung lediglich das Tumorwachstum zu stoppen. Die Bestrahlung stellt hierbei also einen Kompromiss dar, besonders in Situationen, in der z. B. mehrere Tumoren vorhanden sind, die sich durch eine einzige Operation nicht entfernen lassen, oder wenn der Tumor für eine Operation schlecht gelegen ist und/oder zu viel gesundes Gewebe durch einen neurochirurgischen Eingriff zerstört würde.
Das Leksell Gamma-Knife wird seit 1994 hauptsächlich zu dem Zweck eingesetzt, Präzisionsbestrahlungen im Gehirn für beschreibbare, kleinere Volumina vorzunehmen. Die Behandlung mit dem Gamma-Knife geht auf den Schwedischen Neurochirurgen Lars Leksell zurück, der bereits in den vierziger und fünfziger Jahren des vorherigen Jahrhunderts mit diesem Verfahren forschte. In die klinische Anwendung gelangte es erstmals 1968. Im Vergleich zur konventionellen (fraktionellen) Strahlentherapie bzw. zum Linearbeschleuniger kann mit dem Gamma-Knife das Zielgebiet genauer definiert werden, so dass weniger gesundes Gewebe geschädigt wird. Dies ist dadurch zu erklären, dass das Gamma-Knife es ermöglicht, die Dosis auf einen Punkt zu konzentrieren.
Für die relativ geringe Eindringtiefe im Kopf ist die von Co60 emittierte Strahlung mit 1,17 und 1,33 MeV ausreichend. 201 im Durchmesser 1 mm messende Co60-Quellen sind in regelmäßigen Abständen zueinander so angeordnet, dass sich die Einzelstrahlen in einem Brennpunkt treffen (Unit Center Point). Die Dosisleistung von 18 mGray/min. addiert sich entsprechend erst im Fokus zu den notwendigen 3,5 Gray/min.
Bei Bestrahlung mit dem Gamma-Knife muss zu Beginn der Behandlung bei jedem Patienten mittels CT oder MRT die genaue Lage des Tumors ermittelt werden. Die MRT-Bilder werden in den Rechner überspielt und die genauen Koordinaten des Tumors ermittelt. Der Kopf des Patienten ist in einen stereotaktischen Metallrahmen eingespannt, der die Koordinaten liefert, damit die Ausrichtung der Strahlungskanäle so berechnet werden kann, dass der Fokus exakt in die Läsion fällt. Der Unit Center Point hat dabei eine Fehlertoleranz von + 0,3 mm. Durch Mehrfacheinstellungen oder durch Verschließen einzelner Felder aus den 201 Strahlungskanälen (Stöpselung der Strahlungsquellen) können auch komplex geformte kleinere Tumoren bestrahlt oder asymmetrische Bestrahlungsfelder (durch ein asymmetrisches Bestrahlungsfeld bei der Bestrahlung eines Vestibularisschwannoms kann beispielsweise der n. Fazialis geschont werden) erreicht werden, bzw. es lassen sich Dosisbelastungen empfindlicher Organe (z. B. Hornhaut/Cornea) durch individuelle Strahlblockung vermeiden.
Die radiochirurgische Behandlung von Vestibularisschwannomen wird international bereits seit 25 Jahren angewandt. Geeignet sind dafür Vestibularisschwannome mit einem Durchmesser von 3 cm, wobei die Behandlungsergebnisse umso besser sind, je kleiner der Tumor ist. Innerhalb von 6 Monaten nach der Therapie ist zunächst eine Größenzunahme des Tumors infolge von Schwellungen im Bestrahlungsgebiet zu beobachten. Nachfolgend erst zeigt sich die wirkliche Größenabnahme, sodass innerhalb des o. g. Zeitraumes keine weitere Therapie eingesetzt werden sollte. In Fällen dennoch fortschreitenden Tumorwachstums muss erneut behandelt werden, doch in der Regel wird davon ausgegangen, dass sich zwei Jahre nach der Therapie der Status des Gehörs stabilisiert.
Die radiochirurgische Behandlung wird entweder ambulant oder im Rahmen eines kurzen stationären Aufenthaltes durchgeführt. Als erster Behandlungsschritt ist es erforderlich, den stereotaktischen Rahmen am Kopf zu befestigen. Dieser wird unter lokaler Betäubung mit vier kleinen Dornen von außen am Schädel festgeklemmt. Dann werden Kernspinaufnahmen angefertigt, auf denen die Tumoren genau zu sehen sind. Spezielle Markierungen am stereotaktischen Rahmen erlauben dem Computer die genaue Zuordnung von Bestrahlungsfeld und Tumor zu berechnen. Falls nötig, werden zusätzliche Untersuchungen wie Computertomografie oder eine Gefäßdarstellung (Angiografie) durchgeführt. Anhand dieser Bilder wird nun für den Tumor ein individueller Bestrahlungsplan berechnet. Im Idealfall wird die Form des Bestrahlungsfeldes exakt dem Tumor nachgebildet und umhüllt diesen vollständig.
Nachdem die Bestrahlungsplanung abgeschlossen ist, erfolgt die eigentliche radiochirurgische Behandlung. Hierbei werden Strahlenpunkt für Strahlenpunkt aneinandergereiht, bis der gesamte Tumor bestrahlt ist. Die Behandlung dauert zwischen 15 und 60 Minuten. Nach der Behandlung wird der stereotaktische Rahmen sofort wieder abgenommen. Da während einer radiochirurgischen Behandlung der Tumor nicht einfach entfernt, sondern abgetötet wird, ist es erforderlich den Verlauf in Abständen regelmäßig zu kontrollieren.
Novalis Shaped Beam Surgery ist ein in der Radiochirurgie zur exakten Bestrahlung von operativ nicht zugänglichem Tumorgewebe eingesetztes Hochpräzisionsgerät. Die exakte Bestrahlung von Tumorgewebe unter Schonung des gesunden Gewebes ist hier möglich. Oft sind sogar wenige Behandlungen notwendig, da die Tumoren dann bereits in der ersten Behandlung zerstört werden. Dadurch ist der Zeitaufwand deutlich geringer.
Besonders bei sehr empfindlichen Organen, wie z.B. dem Gehirn, ist die exakte Positionierung der Strahlung von großer Bedeutung, da es hier verheerende Auswirkungen hätte, wenn nicht nur Tumorgewebe, sondern auch nebenliegende Bereiche, wie z.B. Koordinationszentren im Kleinhirn oder motorische bzw. sensorische Zentren zerstört würden.
BrainLab hat mit Novalis ein Gerät entwickelt, mit dem sehr effektiv und zugleich schonend behandelt werden kann. Früher wurden Tumore mit einem runden Strahl aus wenigen verschiedenen Richtungen behandelt. Es wurde dadurch auch viel gesundes Gewebe zerstört. Novalis bestrahlt den Tumor aus einer Vielzahl von Richtungen, wobei das Novalis-System den Strahl kontinuierlich der Form und Größe des Tumors anpasst.
Die Dosis aus jeder Richtung beträgt weniger als ein Prozent der Gesamtmenge; dagegen ergibt sich im Schnittpunkt dieser Strahlen eine Konzentration von nahezu 100%! Damit wird im Tumor eine hohe Strahlenkonzentration erzielt. Dies zerstört zwar den Tumor, das umliegende Gewebe jedoch wird nicht oder nur sehr schwach geschädigt.
Bei Gehirntumoren wird ein Kopfring angebracht, der als Koordinationshilfe dient und den Bezugspunkt von Kopf zur Lage des Tumors herstellt. Kurz vor der Bestrahlung können aus zwei verschiedenen Winkeln Röntgenbilder gemacht werden, die über die momentane Position des Patienten Auskunft geben. Diese Daten werden mit vorab in der Datenbank abgelegten 3D- Daten aus dem Computertomografen verrechnet und so können kleinste Abweichungen von der Sollposition ermittelt werden. Es wird außerdem die optimale Bestrahlungsdosis errechnet und das Zielvolumen des Tumors dreidimensional auf einem Bildschirm dargestellt. Erst danach erfolgt die eigentliche Bestrahlung.
Diese Behandlung ist weitestgehend schmerzfrei und wird in den meisten Fällen ohne Narkose durchgeführt. Ein längerer Aufenthalt in der Klinik oder in einem Rehabilitationszentrum ist daher auch nicht erforderlich.
Außerdem werden Elektronenbeschleuniger eingesetzt. Elektronen sind winzige, negativ geladene Teilchen. Die Quelle, in der sie erzeugt und ausgesendet werden, ist ein Glühdraht. Die dort produzierten Elektronen werden in einem Hochvakuum-Rohr so beschleunigt, dass sie nahezu Lichtgeschwindigkeit haben. Am Ende des Rohres werden die Elektronen mit Hilfe eines starken Magneten in ihrer Bahn auf die gewünschte Richtung umgelenkt. So können die Elektronen direkt zur Therapie eingesetzt werden. Sie werden dabei mit einer so genannten Streufolie über eine definierte Fläche verteilt und für die Bestrahlung oberflächlicher Tumoren einsetzt.
Linearbeschleuniger erzeugen zwei Arten von Strahlen: erstens solche, die sich vor allem für die Behandlung tiefliegender Tumore eignen und zweitens negativ geladene Teilchen (Elektronen), die hingegen nur wenige Zentimeter ins Gewebe eindringen und deshalb zur Therapie nahe der Oberfläche gelegener Krankheitsherde verwendet werden. Die biologische Wirkung der verschiedenen Strahlen am Tumor ist jedoch gleich. Moderne Bestrahlungsgeräte sind technisch äußerst kompliziert aufgebaut. Außerdem verfügen die Bestrahlungsgeräte über eine Vielzahl von "Sicherungen". So gibt das Gerät die Bestrahlung nur dann frei, wenn sämtliche Einzelheiten (z.B. Größe des Feldes, Winkel, Bestrahlungszeit) genau mit den geplanten und im Computer gespeicherten Daten übereinstimmen.
Im Gegensatz zum Kobaltgerät, in dem die Strahlung durch eine radioaktive Quelle im Innern eines abgeschirmten Strahlerkopfes erzeugt wird, entsteht die Strahlung beim Linearbeschleuniger nur auf Knopfdruck. Es werden Elektronen in einem Glühdraht erzeugt und in einem Hochvakuum-Rohr so beschleunigt, dass sie nahezu Lichtgeschwindigkeit erhalten. Durch Aufprall auf ein wassergekühltes Metall werden die Elektronen abrupt abgebremst und durch Energieumwandlungsprozesse entstehen dabei Photonen (auch als ultraharte Röntgenstrahlen bezeichnet, s.o.). Photonen können aufgrund ihre physikalischen Eigenschaft - im Gegensatz zu Elektronen - tiefer in den Körper eindringen als beispielsweise Kobaltstrahlung.
Unter dem Begriff stereotaktische Strahlentherapie wird die Technik verstanden, die durch eine hochpräzise Bestrahlung auf ein räumlich exakt definiertes Zielvolumen charakterisiert ist. Das gesunde Gewebe wird so maximal geschont. Das stereotaktische Koordinatensystem ist durch mindestens drei Punkte eindeutig mit dem stereotaktischen Rahmen verbunden. Durch Fixierung des stereotaktischen Rahmens am Patienten sind jedem Punkt des Zielvolumens dreidimensionale Koordinaten zugeordnet. Die präzise stereotaktische Lokalisation des Zielvolumens verbunden mit der exakten Positionierung des Patienten während der Therapie charakterisieren die Methode.
Bei der Stereotaktischen Strahlentherapie werden Röntgenstrahlen aus verschiedenen Richtungen auf das Zielvolumen eingestrahlt. Linearbeschleuniger und Bestrahlungstisch rotieren um den Patienten. Mit Hilfe der stereotaktischen Koordinaten wird der Zielpunkt im Körper des Patienten definiert und ins Zentrum des Linearbeschleunigers eingestellt. Wird die gesamte Strahlendosis in einer Sitzung appliziert, nennt man die Methodes Stereotaktische Einzeitbestrahlung. Die Bestrahlung in mehreren Sitzungen wird Stereotaktische Fraktionierte Strahlentherapie genannt. Durch eine stereotaktische Fraktionierte Strahlentherapie wird das gesunde Gewebe weitgehend geschont. Der Linearbeschleuniger und das Gamma Knife sind hinsichtlich der Präzision vergleichbar, was sich in den vergleichbaren klinischen Ergebnissen der Behandlung cranieller Läsionen widerspiegelt.
In der Technologie der stereotaktischen Strahlentherapie am Linearbeschleuniger wurden in den letzten Jahren grundlegende Fortschritte erzielt. Durch die langjährige Erfahrung und große Zahl der behandelten Patienten ist die ,,Kopfstereotaxie’’ mittlerweile eine etablierte Methode, während sie im Körperbereich noch einen klinisch-experimentellen Charakter hat. Die Kombination der stereotaktischen Strahlentherapie am Linearbeschleuniger mit der intensitätsmodulierten Strahlentherapie (IMRT) kombiniert den Vorteil der geometrisch präzisen Strahlenapplikation mit dem Vorteil einer hoch präzise gesteuerten Dosisverteilung. Dies eröffnet neue Perspektiven und wird bei gegebenen Indikationen die Strahlentherapie sicher noch wirkungsvoller machen.
Die Stereotaktische Strahlentherapie und die Radiochirurgie haben sich als wichtige Therapieoptionen in der Behandlung von craniellenTumoren etabliert. Die stereotaktische Strahlentherapie kann als alleinige Strahlentherapieform oder in Kombination mit anderen Bestrahlungsmethoden angewendet werden. Die klassischen Indikationen sind zum Beispiel Hirnmetastasen, Vestibularisschwannome oder Meningeome etc. Bei Vestibularisschwannomen stellen die Radiochirurgie (bei kleineren Tumoren) und die stereotaktische fraktionierte Strahlentherapie (bei größeren Läsionen) mittlerweile eine wichtige Alternative zur Mikrochirurgie dar. Die Technologie der Stereotaktischen Fraktionierten Strahlentherapie am Linearbeschleuniger erlaubt gleichmäßige Bestrahlung nicht nur kleinerer, sondern auch größerer Tumoren (bis ca. 10 cm).
Eine direkte Kontaktmöglichkeit zum Cybreknife Zentrum Mitteldeutschland finden Sie hier.
Chancen der stereotaktischen Präzisionbestrahlung bei der Behandlung von NF2-Tumoren
Zusammenfassung eines Vortrages von PD Dr. Klaus Hamm
Dr. Hamm ist Leiter Cyberknife Zentrum Mitteldeutschland im Helios-Klinikum Erfurt. In dieser interdisziplinären Abteilung arbeitet er als Neurochirurg zusammen mit einer erfahrenen Strahlentherapeutin und einem Medizinphysiker/-techniker. In der Radiochirurgie kooperiert das HELIOS Klinikum Erfurt mit dem Cyberknife-Zentrum Mitteldeutschland, das sich seit Herbst 2012 auf dem Gelände des HELIOS Klinikums Erfurt befindet und wegweisend ist. Es bedeutet, dass Mikrochirurgen (also Operateure), Radiochirurgen, Neuroradiologen und Neurologen immer eng zusammenarbeiten und bei der Behandlung von NF2-Patienten individuell alle Therapiemöglichkeiten kritisch gegeneinander abgewogen und ausgewählt werden.
Folgende Abkürzungen sind wichtig zum Verständnis des Textes: RS bedeutet einmalige Präzisionsbestrahlung mit einer hohen Dosis (mit Gamma Knife oder Cyber Knife, möglich ist es auch mit Novalis)
SRT bedeutet fraktionierte Präzisionsbestrahlung mit täglichen kleinen Einzeldosen ("Fraktionen") etwa mit Novalis (aber nicht mit Cyber Knife).
Beide Verfahren werden in Erfurt (Gerätetyp "Novalis") individuell abgestimmt angewendet.
Gy (Abkürzung von "Gray") ist die Maßeinheit für die Strahlendosis.
AN bedeutet Akustikusneurinom (=Vestibularisschwannom) - diese häufigsten Tumore bei NF2 wollen wir jetzt näher betrachten
Die häufigste Begleiterscheinung von NF2 sind beidseitige Akustikuseurinome
Unten sieht man die Möglichkeiten, ein Akustikusneurinom zu behandeln. Oberstes Ziel muss immer sein, die größtmögliche Chance auf einen Funktionserhalt der Nerven zu haben.
- Warten und Kontrollieren
- Operieren bei kompletter Entfernung des Tumors (Exstirpation) oder bei teilweiser Entfernung (Resektion), um Funktionen zu erhalten. Die Operation ist immer Methode der Wahl, wenn AN so groß sind, dass sie den Hirnstamm komprimieren
- Radiochirurgie/stereotaktische Radiotherapie (einmalig oder fraktioniert), diese Behandlung ist vor allem für kleinere Tumoren (bis 3cm) geeignet.
- Eine weitere Behandlungsmöglichkeit ist eine Kombination aus den beiden vorgenannten:Zuerst operieren (Resektion), dann stereotaktisch bestrahlen. Diese Kombination ermöglicht eventuell einen sichereren Funktionserhalt, der ja immer das oberste Ziel bei der Behandlung dieser Tumoren sein muss. Diese kombinierte Behandlung eignet sich auch für große Akustikusneurinome.
Die stereotaktische Bestrahlung (einmalig oder fraktioniert) eignet sich besonders gut für gutartige Tumoren. Das ist so, weil die Bestrahlungsdosis am Rand des Tumors wie messerscharf abfällt. Gutartige Tumoren sind Meningeome, Neurinome und andere, also auch Akustikusneurinome und alle anderen NF2-Hirntumoren.
Alle stereotaktischen Bestrahlungen haben das gleiche Ziel: die Devitalisierung (Abtötung) des Tumors. Das heißt, man möchte, dass sich die Tumorzellen nicht weiter teilen und damit vermehren können.
Dazu werden die Strahlen aus verschiedenen Richtungen so in den Kopf "gelenkt", dass sie sich an einem genau definierten Punkt (dem Zielpunkt = Isozentrum) treffen. Dieser Zielpunkt wird durch einen automatischen Lamellen-Kollimator immer an die jeweilige Tumorgröße (an den Tumorrand) angepaßt und dort (und nur dort) wird die Dosis erreicht, die das Tumorgewebe zerstört. Am Rand des Tumors fällt die Strahlendosis dadurch steil ab und das umgebende, gesunde Gewebe wird geschont.
Vorbereitung der Bestrahlungen
Voraussetzung für die Genauigkeit ist die Fixierung des Kopfes - bei einmaliger Bestrahlung (RS) durch einen stereotaktischen Ring, bei Bestrahlung in täglichen kleinen Einzeldosen (SRT) mit einem vorher individuell angepassten stereotaktischen Maskensystem. Dieses Maskensystem besteht aus zwei Teilen (Hinterkopf und Gesicht), die durch Klips am Maskengestell verbunden werden. Diese aus im Wasserbad erwärmtem Kunststoff-Netz bestehenden Teile werden bei der Anpassung anmodelliert und bei der Abkühlung in dieser Form fixiert. Dabei darf der Patient auf keinen Fall den Kopf und das Gesicht bewegen, das würde die Genauigkeit von plus/minus 1-2 mm gefährden.
Die gewünschte, millimetergenaue Präzision verlangt für den gesamten Ablauf raffinierte technische Verfahren. Erforderlich ist eine hohe mechanische Stabilität des gesamten Systems, außerdem ein Stereotaxie-tauglicher Spezial-Linearbeschleuniger, der mit einem Mikro Multi LamellenKollimator (MMLC) ausgerüstet ist. Die Lamellen müssen sehr dünn sein, bei "Novalis" sind es 3 mm, die eine genaue Anpassung der Lamellen an den Umriss des Tumors erlauben.
Vor der RS / SRT muss ein MRT und ein stereotaktisches CT (mit der Kopffixierung!) für die 3D-Bestrahlungsplanung gemacht werden. Die beiden Datensätze dieser Aufnahmen werden anschließend zur Deckung gebracht (automatische Bildfusion). Damit können die notwendigen Informationen beider Untersuchungstechniken optimal für die Planung der RS/SRT genutzt werden. Tumor und sogenannte Risikostrukturen (besonders strahlenempfindliche Strukturen wir Hirnstamm, Augen, Nerven) werden nun Schicht für Schicht definiert, denn die Strahlen müssen so dosiert werden, dass gesundes Gewebe nicht und der Tumor optimal geschädigt wird. Ihre zerstörerische Kraft erreichen sie nur in dem durch die Lamellen auf die Tumorgröße angepassten Zielpunkt, wo sie sich aus allen Einstrahlrichtungen treffen. Das kann man sich vorstellen wie die Sonnenstrahlen, wenn sie durch eine starke Lupe auf den Brennpunkt gelenkt werden und da einen Brand entfachen können. Dieser definierte Zielpunkt im Tumorvolumen ist das Isozentrum. Es wird mit einer Genauigkeit von plus/minus 0,1 mm exakt eingestellt.
Für das stereotaktische Planungs-CT wird am im Ring oder Maskensystem fixierten Kopf noch eine Lokalisations-Box angebracht, die mit Markern ausgestattet ist. Wenn der Computer diese Marker hat, ist der Kopf im dreidimenionalen Koordinatensystem lokalisiert und jetzt kann jeder Punkt auf hundertstel Millimeter genau bestimmt werden, hier natürlich der Zielpunkt (das Isozentrum) im Tumor.
Das stereotaktische CT wird lokalisiert und mit dem vorher angefertigten MRT in mehreren Schritten automatisch fusioniert. Das kann man dann noch prüfen und eventuell von Hand korrigieren, es ist aber zumeist nicht nötig.
Durchführung der Bestrahlungen
Während der Bestrahlung bewegt sich das Bestrahlungsgerät (hier: Novalis) in einer Rotationsbewegung um den Kopf bei einer definierten Tischposition (dynamische Bogen-Bestrahlung). Dann wird dieser Tisch, auf dem der Patient liegt, in eine andere Position gedreht und es wird wieder in einem dynamischen Bogen bestrahlt. Die notwendige Genauigkeit wird dabei ständig überwacht. Die Strahlen kommen wie aus einer Halbkugel aus allen Richtungen. Sie sind immer konvergent, also zielen alle auf das Isozentrum (im Tumor). Gesundes Gewebe und Risikostrukturen im Tumor können ausgespart werden, so erreicht man eine geringe Strahlenbelastung dieser Gewebe.
Ein großer Vorteil der fraktionierten Bestrahlung:
Man kann damit auch Tumoren bestrahlen, die etwas größer sind. Bei einmaliger Bestrahlung (etwa im Gamma Knife) sind Funktionsverluste der beteiligten Nerven (gerade bei NF2) gefürchtet.
Fraktionierte Präzisionsbestrahlung (SRT) kann bei gleich guten Ergebnissen der Tumorkontrolle (das bedeutet Wachstumsstopp oder Schrumpfen des Tumors) gesundes Gewebe und Nerven besser schonen.
In Erfurt wird interdisziplinär und individuell nach Tumorgröße und Nervenfunktionen entschieden, ob RS oder SRT empfohlen wird - beide Verfahren sind mit dem Novalis möglich und werden durchgeführt.
Ergebnis: Präzisionsbestrahlung wirkt am besten bei kleinen, nicht voroperierten gutartigen Tumoren. Die Strahlendosis soll möglichst niedrig so gewählt werden, dass sie eine ausreichende Tumorkontrolle gewährleistet.
Fraktionierung lässt die Einzeldosierungen sehr niedrig werden und minimiert das Risiko von Nervenschäden. Bei voroperierten Tumoren steigt die Gefahr von Komplikationen, ebenso bei zunehmender Größe des Tumors (wegen der größeren Länge, auf der die einzelnen Nerven bestrahlt werden). Eine Tumorkontrolle kann in >= 90% der Fälle erreicht werden.
Medikamentöse Therapie
Neue Medikamente geben Anlass zur Hoffnung: Insbesondere Avastin bringt in der Mehrzahl der Fälle Akustikusneurinome zum Schrumpfen.
Medikamentöse Behandlungsmöglichkeiten
Noch vor wenigen Jahren waren die Behandlungsmöglichkeiten von NF2-Tumoren begrenzt. Für NF2-Betroffene stand fest, dass in bestimmten, nicht planbaren Abständen eine mikrochirurgische Operation oder Bestrahlung zur Tumorbehandlung erfolgen musste. Beides ist mit Risiken für Nervenfunktionen verbunden, sodass die Betroffenen mit mehr oder weniger zunehmenden Behinderungen rechnen mussten.
Mit medikamentösen Behandlungsmöglichkeiten wird nun darauf abgezielt, NF2 Tumore in Schach zu halten oder sogar zu verkleinern. In den letzten Jahren zeigten sich zahlreiche Ansätze und bereits heute profitieren einige NF2-Betroffene von medikamentösen Therapien. Es besteht also nicht nur ein berechtiger Anlass zur Hoffnung, sondern für einige NF2-Betroffene bereits jetzt die Möglichkeit, die Lebensqualität durch medikamentöse Behandlung zu verbessern. Bestrahlung und Chirurgie sind damit nicht länger automatisch die erste Therapiewahl.
Eine etwaige medikamentöse Intervention ist jedoch situationsabhängig abzuschätzen. Da diese Therapieform noch sehr jung ist, gibt es praktisch keine Langzeiterfahrungen. Es gibt noch keine medikamentöse Therapie, mit der sichergestellt werden kann, dass zeitnah Tumoren bei allen Betroffenen zu Tumorwachstumsstillstand oder gar Tumorschrumpfung führt. Daher ist es z.B. in kritischen Situation sinnvoller, sich für die die traditionelle Verfahren der Bestrahlung oder Chirurgie zu entscheiden. Beachtet werden sollte auch, welche Art von Tumor behandelt werden soll. Die meisten verfügbaren Medikamente zielen auf Schwannome.
Besondere Aufmerksamkeit hat in den letzten Jahren das Krebsmedikament Avastin erhalten (Wirkstoff: Bevacizumab). Wie bei vielen der neuen Medikamente, zielt Avastin auf die antiangiogenetische Wirkung (Wikipedia: Angiogenese), welche die Bildung von Blutgefäßen hemmt. Dadurch wird die Versorgung des Tumors bzw. der Tumoren gekappt. Diese Therapieform hat sich in den letzten Jahren in der Krebsmedizin durchgesetzt, ist also bereits außerhalb von NF2 gut erforscht.
Seit 2007 wird Avastin auch zur Behandlung gutartiger NF2-Tumoren eingesetzt. Die Avastintherapie ist eine Art der Chemotherapie, jedoch sind die Nebenwirkungen im Vergleich zur Behandlung bei Krebspatienten oftmals wesentlich geringer ausgeprägt.
In der Praxis
In den USA ist die Forschung am Weitesten. So laufen dort seit nunmehr 5 Jahren schon Studien zu Avastin, bei denen NF2-Patienten damit versorgt werden. Andere Medikamente kommen fortlaufend hinzu. In Deutschland war es zu Beginn sehr schwierig, an Avastin zu kommen, da es noch neu war und somit die Krankenkassen noch nicht viel Bereitschaft zeigten, die hohen Kosten zu übernehmen, die sich pro Infusion auf über 1000 Euro belaufen. Außerdem wurde keine Studie begonnen (die gut eine Million Euro kosten würde), sondern lediglich ein Heilversuch für maximal 6 Patienten von dem Neurologen Prof. Mautner in Hamburg. Inzwischen ist es auch möglich über den behandelnden Neurochirurgen an eine Avastintherapie zu kommen.
Weiterführende Informationen zu Avastin finden Sie in dieser Avastin FAQ und weiter unten ist noch eine Befragung zu finden von 6 Patienten aus Deutschland, die mit Avastin behandelt werden/wurden.
Erfahrungen der letzen 5 Jahre in der internationelen NF2-Gemeinschaft (jedoch hauptsächlich den USA) haben gezeigt, das Avastin meist nur bei Akustikusneurinomen wirkt, bei der Vielzahl der Patienten ergibt sich medizinisch gesehen eine Schrumpfung der AKNs von 15% oder mehr. Im Alltag berichten einige von einer Verbesserung des Gehörs, von Verbesserungen des Gleichgewichts und auch mehr Lebenslust.
Es können jedoch auch Nebenwirkungen auftreten: Über Mattigkeit am Tag der Infusion wird von vielen berichtet, einige wenige berichten auch von Bluthochdruck oder zu niedrigem Blutdruck, Veränderung der Leberwerte, etc. (Siehe FAQ Avastin) In wenigen Fällen waren die Nebenwirkungen so stark, dass die Avastintherapie abgebrochen werden musste.
In den USA werden auch bereits andere Medikamente verabreicht, die auch bei anderen Tumorarten greifen. Da diese noch relativ neu sind, gibt es noch nicht so viele Erfahrungen, jedoch nehmen in den USA einige das Medikament Lapatinib (Wikipedia: Lapatinib); Mehr Infos beim Link zur NYC support group unten), welches auch zu Schrumpfungen und Wachstumsstop führte. Eine der neuesten Entdeckungen ist Everolimus oder Afinitor (RAD-001) (Wikipedia: Everolimus) zu dem in den USA auch Studien begonnen haben.
Einige NF2-Ärzte in Deutschland sind nicht auf dem neuesten Stand der Entwicklungen im medikamentösen Bereich und sind daher nicht in der Lage dieses oder jenes Medikament zu empfehlen. Daher gilt: Selber gut informieren (zum Beispiel in den englischsprachigen yahoogroups „NF2 Crew“ oder „trialtalk“) und dann relevante Medikamente mit dem Arzt besprechen (und mit der Krankenkasse!).
Eine Liste zu aktuell in den USA laufenden Studien zu Medikamenten und deren Wirksamkeit bei NF2 mit weiterführenden Informationen finden Sie hier: Tumor Surpressors
Avastin (Bevacizumab)
Erlotinib
Everolimus (Rad-001)
Imatinib
Lapatinib
Nilotinib
SOM230
Sorafenib
PTC299
Sunitinib
Sirolimus
Cetuximab
Trastuzimab
Vandetanib
Dasatinib
Nintedanib
BEZ235
PTC124, Ataluren
(Thalidomid)
AR42, OSU HDAC42
AR12, OSU 03012
Die meisten der obenstehenden Medikamente sind Krebsmedikamente.
Es wird jedoch auch an Medikamenten geforscht, welche aus der Naturmedizin kommen und ebenfalls mittels Anti-Angiogenese oder anderen Tumor-Wachstumsmechanismen das Wachstum der Tumoren hemmen. Anführer hier ist Propolis (Propolis FAQ).
Medikamente aus diesem Bereich:
Propolis
Boswelia
Bio-Curcumin
Omega 3 Fettsäuren
Zyflamend
Honokiol
Resveratrol
Viele Angiogenese hemmende Stoffe finden sich auch in gängigen Lebensmitteln. Durch Essen dieser Nahrungsmittel kann selbst auch aktiv durch gezielte Ernährung gegen die Versorgung von Tumoren entgegengewirkt werden.
Leider gibt es bis heute keine medizinschen Erfahrungen mit der Wirksamkeit dieser Medikamente auf andere Tumoren der NF2 (wie zum Beispiel spinale Tumoren). Aus der Nuklearmedizin gibt es jedoch die Therapien mit Sandostatin oder DOTATOC, welche jedoch keine Chemotherapien sind (FAQ).
Es tut sich also einiges. Da der medikamentöse Bereich noch jung ist und es daher noch nicht viel Erfahrungen gibt, ist es noch nicht möglich, genaueres zu sagen. Dennoch gibt es bei diversen Medikamenten schon Erfolge zu verzeichnen.
Viele weitere Informationen zur medikamentösen Behandlung von NF2 finden Sie auf den nachfolgenden Seiten
NF2 Information and Services
(mit Übersetzen-Button auf jeder Seite!)
In unserem NF2-Mailing-Forum gibt es bereits 6 NF2-Betroffene, die mit Avastin behandelt wurden bzw werden.
Wir haben ihnen allen einen Fragenkatalog vorgelegt, Sie finden jeweils unter einer Frage alle sechs Antworten.
Die sechs Leute sind überwiegend jung (in den zwanzigern und dreißigern), einer ist schon etwas älter (Tom).
Die Namen stimmen nicht mit ihren wirklichen Namen überein.
Ihr werdet seit einiger Zeit bzw. wurdet einige Zeit mit Avastin behandelt, wie kam das? Wer hat sie verordnet? Wann hat eure Therapie begonnen?
Mia: Aufmerksam auf Avastin bin ich durch unser NF2Forum geworden. Ich habe mich mit dem Thema dann auseinandergesetzt und mit meinen Neurochirurgen darüber gesprochen. Auch er hat es befürwortet, die Therapie zu beginnen. Wir haben einen Antrag bei meiner Krankenkasse gestellt und als dieser bewilligt wurde, habe ich Kontakt mit Prof. Mautner aufgenommen, mich vorgestellt, alles besprochen und schwups wurde ich mit Avastin behandelt.
Die Therapie hat im November 2010 begonnen, verordnet von meinem Neurochirurgen und Prof. Mautner.
Anna: Aufgrund meines AKN, das man nicht gehörerhaltend hätte operieren können, bekam ich das Avastin – ein Jahr lang, von August 2010 bis August 2011.
Bei mir lief die Verordnung über die UniklinikTübingen.
Wolf: Ich bin Mitte 20 und hatte bereits zwei Operationen an den Akustikusneurinomen (AN) hinter mir. Da ein AN progredient (im Wachstum, d.Red.) und eine hörerhaltende Operation nicht möglich war, bestand die einzige Chance auf Hörerhalt in einem Therapieversuch mit Avastin.
Tom: Auf mein Drängen hin hat Prof. Mautner mir die Avastin-Behandlung verordnet, Beginn war September 09. Wegen der großen Entfernung nach Hamburg wurde die Behandlung am Universitätsklinikum Tübingen durchgeführt.
Suse: Ich war von Beginn meiner NF2-Krankengeschichte Patientin von Prof. Mautner, und da meine AN immer schneller wuchsen und mein Restgehör gefährdeten, hat er mir als einer der ersten eine Avastin-Therapie vorgeschlagen. Das war 2008. Die Behandlung wurde in Hamburg durchgeführt, wohin ich auf eigene Kosten alle 14 Tage fahren musste, um eine Infusion zu bekommen.
Max: Ich bin zunächst durch die Empfehlung eines befreundeten NF2-Betroffenen darauf aufmerksam geworden. Dann habe ich auf eigene Faust viel darüber recherchiert, da ich eine weitere OP, die von vielen Ärzten vorgeschlagen wurde, abgelehnt habe aufgrund meines schwachen Zustands und der Folgen der vorhergehenden OP. So kam ich dann zu Prof. Mautner in Hamburg und wir haben vereinbart dass eine Avastintherapie in meiner Situation (zwar schon ertaubt, aber großer Druck auf den Hirnstamm durch die Tumoren) einen Versuch wert ist.
Begonnen hatte ich im September 2009, in äußerst schlechtem gesundheitlichen Zustand (Magensonde, Rollstuhl, Depression, als 24 Stunden Pflegefall u.v.m.)
Avastin ist ein Krebsmedikament, das man nicht einfach so schlucken oder spritzen kann. Eine Avastin-Behandlung ist eine Chemotherapie und muss in regelmäßigen Abständen erfolgen. Wie war und ist das bei euch? Wo und von wem wird sie durchgeführt? Wie ist der Ablauf?
Mia: Die Therapie hat im November 2010 begonnen, verordnet von meinem Neurochirurgen und Prof. Mautner.Die Behandlung wurde anfangs in der Uniklinik Hamburg in zweiwöchigen Rhythmus durchgeführt, seit Januar 2012 in dreiwöchigen Rhythmus. Die Infusionsgabe dauert maximal eine halbe Stunde. Meine Avastin-Infusionen bekomme ich seit 2012 in der Charité Berlin, da sie für mich einfacher zu erreichen ist. Die Studie läuft weiterhin über Prof. Mautner in der Uni-Klinik Hamburg, er erhält aktuelle Befunde von der Charité und leitet die vierteljährlichen Untersuchungen (Kontroll-MRT, Hörtests, AEP) und Besprechung des momentanen Gesundheitszustandes. Der weitere Ablauf wird vorerst der dreiwöchige Rhythmus sein. Für wie lange, kann man nicht sagen, es hängt von den vierteljährlichen Untersuchungen und Auswertung ab.
Anna: Ich musste alle zwei Wochen zur Infusion. Da ich sehr weit von Tübingen weg wohne (Amberg) und noch dazu in Augsburg studiere (noch weiter weg von Tübingen), habe ich die Infusionen ambulant in der Onkologie im Amberger Krankenhaus bekommen. Der Onkologe dort war nicht sonderlich motiviert und hat immer wieder betont, dass er mir die Infusionen nur gibt, weil ICH das will, Er stand wohl nicht so dahinter, aber es war mir egal. Hauptsache, ich habe sie bekommen. MRT-Kontrollen wurden ebenfalls im Amberg gemacht.
Wolf: Ich wurde zunächst im Zwei-Wochen-Rhythmus im Universitätsklinikum Hamburg-Eppendorf behandelt, nun im 3-Wochen-Rhythmus in der Berliner Charité. Vor jeder Behandlung wird Blut abgenommen und untersucht. Avastin wird – bei guter Verträglichkeit – in 30min per Infusion verabreicht. Ich verspüre danach für einige Zeit eine sehr leichte Müdigkeit, bin aber in meinem Handeln nicht eingeschränkt.
Tom: Die erste Serie erfolgte im 14tägigem Rhythmus über 6 Monate. Die zweite und dritte Serie alle 3 Wochen ebenfalls über je 6 Monate.
Behandelt wurde ambulant im UKT Tübingen. Ich fahre am selben Tag wieder zurück.
Suse: Wie schon erwähnt wurde meine Behandlung in Hamburg durchgeführt. Ich war eine der ersten NF2-Betroffenen, die Avastin bekamen, damals gab es noch nicht viele Onkologen, die das gemacht haben. Die Behandlung selbst dauerte jeweils nicht lange, ich bekam zwei Spritzen gegen Übelkeit und allergische Reaktion und dann kam die Infusion. Nach 1,5 Stunden war es vorbei.
Max: Zunächst wurde Avastin im Zwei-Wochen-Zyklus per Infusion verabreicht. Die ersten beiden Infusionen erfolgten im UKE Hamburg (in der Onkologieabteilung). Nachdem wir dann gesehen hatten dass ich Avastin gut vertragen habe, wechselte ich zur örtlichen Uni-Klinik in meiner Heimatstadt Würzburg wo die Infusionen ohne Probleme weiter durchgeführt wurden. Die Intervalle wurden ebenfalls innerhalb eines Jahres schrittweise erhöht auf eine Infusion alle 4 Wochen
Wer schon erste Kontroll-MRTs hat: wie sind die Ergebnisse im Vergleich zu den Aufnahmen vor der Avastin-Behandlung?
Gibt es eine medizinisch gemessene Schrumpfung der Tumoren?
Welche Verbesserungen oder Verschlechterungen sind sonst durch die Behandlung eingetreten?
Mia: Die erste Schrumpfung des AKN links konnte man bei mir nach einem Vierteljahr bemerken. Insgesamt wurde nach einem Jahr Behandlung eine 25%Schrumpfung des AKN links gemessen.Bei mir ist eine deutliche Hörverbesserung links eingetreten die man im Audiogramm deutlich messen kann.Ich fühle mich auch weniger träge. Ich treibe mehr Sport als vorher und fühle mich insgesamt besser.Verschlechterungen kann ich eigentlich nicht nennen. Neue MRT- Bilder zeigen zwar ein rasches Wachstum einiger Meningeome in meinem Kopf. Jedoch kann man nicht sagen, ob es durch das Avastin hervorgerufen wurde. Das muss weiter beobachtet werden.
Anna: Die Therapie war bei mir leider nicht von Erfolg gekrönt. Nach dem ersten halben Jahr sah es so aus, als wäre das Wachstum gestoppt worden, die Tumorgröße war in etwa so wie zu Beginn der Behandlung. Nach einem weiteren halben Jahr wurde dann leider festgestellt, dass der Tumor wieder wächst.
Verbesserungen sind durch die Behandlungen gar keine eingetreten, Hörverschlechterung durch das Tumorwachstum leider schon.
Wolf: Eine deutliche Größenreduktion des Akustikusneurinoms war nach dreimonatiger Behandlungsdauer erkennbar. Darüber hinaus eine sehr deutliche Größenreduktion eines zystoiden Tumoranteils im HWS-Bereich nach einer Behandlungsdauer von 6 Monaten. Aufgrund der Größenreduktion des Akustikusneurinoms hat sich das Gehör klar verbessert. Nach einem zwischenzeitlichen Absetzen der Medikation mit Avastin und einer darauf folgenden Größenzunahme des AN wurde die Medikation wieder angesetzt, der Tumor hat sich wieder verkleinert.
Tom: Nach der ersten Serie ergab sich durch die Volumetrie- Berechnung eine Volumenverkleinerung von 27,8%. Mein Gehör hat sich dadurch leider nicht verbessert – vielleicht, weil ich schön älter bin und die Hörschädigung schon lange besteht?
Suse: Bei meiner ersten Kontrolle sowie bei allen weiteren konnte keine Veränderung beim Wachstum meiner ANs festgestellt werden, sie wuchsen weiter.
Max: Nach zwei Jahren Infusion wurde eine Schrumpfung des Volumens auf beiden Seiten von 22% gemessen.Avastin hat meinen Krankheitsverlauf auf den Kopf gestellt. Inzwischen laufe ich wieder, treibe sogar leichten Sport, esse normal und habe eine Lebenslust wie ich sie sonst nie verspürt habe.
Die Avastin-Behandlung ist sehr teuer, bezahlt das bei euch die Krankenkasse? Seid ihr gesetzlich oder privat versichert? Hattet ihr Probleme bei der Kostenübernahme?
Mia: Ich bin gesetzlich versichert. Die Bewilligung meines Antrages hat ein Jahr gedauert, es wurden Gutachten angefordert sowie der MDK eingeschaltet. Dann wurde es bewilligt. Der erste bewilligte Zeitraum der Behandlung beträgt 6 Monate, dann muss man die Kostenübernahme erneut beantragen mit Belegen, was sich verbessert hat. Bisher wurde kein erneuter Antrag abgelehnt.
Wolf: Die Therapie wird von meiner privaten Krankenkasse übernommen.
Anna: Bei mir hat das die Krankenkasse übernommen, ich bin gesetzlich versichert. Probleme gab es da eigentlich nicht, sie waren mir gegenüber sehr offen. Ich habe halt persönlich mit den Leuten geredet und den Ernst der Lage so dramatisch dargestellt, wie er auch ist, dann waren sie eigentlich sehr schnell bereit, die Kosten zu übernehmen.
Tom: Ich bin Beamter, damit bin ich sog. Selbstzahler und erhalte zur Kassenerstattung (50% privat) auch Bundesbeihilfe.
Die erste Serie wurde mir umgehend bewilligt. Bei Beantragung der zweiten Serie bekam ich den Bescheid, dass Avastin verschreibungspflichtig ist und wenn mir das ärztlich verordnet würde, werde es auch bezahlt.
Ausnahmsweise mal kein Kampf.
Suse: Meine gesetzliche Kasse hat es leider nicht bezahlt. Nachdem Prof. Mautner mir so von dem neuen Wundermittel vorgeschwärmt hatte, glaubte ich es versuchen zu müssen und habe bei Verwandten und Freunden Kredite aufgenommen. Wir dachten, bei erfolgreichem Verlauf würde die Kasse es doch erstatten.
Max: Meine private Versicherung hat bisher alle Rechnungen ohne einen Mucks bezahlt, es bedarf nicht mal einer Vorabklärung der Kostenübernahme. Ich würde so eine Vorabklärung dennoch empfehlen.
Spürt ihr Nebenwirkungen (bzw. habt ihr sie gespürt)? Welche?
Mia: Als Nebenwirkungen sind bei mir eigentlich nur die übliche Müdigkeit nach der Infusionsgabe aufgetreten, dazu leichtes Nasenbluten, wenn man sich die Nase schneuzt, das ist aber minimal. Ansonsten spüre ich bis jetzt keine Nebenwirkungen.
Anna: Ich habe viele Nebenwirkungen gespürt.
Im ersten halben Jahr noch weniger, aber im zweiten wurde es dann immer schlimmer. Müde und erschöpft war ich nach jeder Infusion, das ist ja aber erträglich als Nebenwirkung. Hinzu kam ein richtiger Druck im Kopf bei der geringsten Belastung (Bergauf gehen, Treppen steigen, Hitze, ...) mit hohem Blutdruck Herzrasen, Kopfschmerzen, ... Ich hatte insgesamt mehr Kopfschmerzen, hab mich ständig schlapp und angestrengt gefühlt, war überhaupt nicht belastbar, ...
Außerdem sind mir am Oberkopf viele Haare ausgegangen.
Wolf: Ich habe keinerlei Nebenwirkungen durch Avastin verspürt. Die leichte Müdigkeit, die mit der Infusion einher geht, klingt nach einigen Stunden völlig ab.
Tom: Ich habe fast keine Nebenwirkungen gespürt. Nur die Zunge reagiert anschließend seltsam empfindlich auf Säure und Schärfe.
Suse: Ich hatte von Anfang an sehr starke Nebenwirkungen. Übelkeit, starke Müdigkeit auch am Tag danach, Antriebslosigkeit, Haarausfall (wie bei einer Mauser), Hautauschläge und Abszesse, meine Immunabwehr war geschwächt und ich habe stark abgenommen. Die Therapie, die eigentlich für ein jahr geplant war, musste nach drei Monaten abgebrochen werden.
Max: Meine Zunge reagiert empfindlich (brennt) bei säurehaltigen und scharfen Lebensmitteln. Sonst keine Nebenwirkungen.
Was ist das Ziel der Avastin-Behandlung? Soll das Tumorwachstum danach auch längerfristig geringer sein? Für welche Dauer ist die Behandlung geplant?
Mia: Ziel der Therapie ist das Schrumpfen der AKN (Akustikusneurinome), so dass mein Restgehör links erhalten bleibt. Andere Tumore in meinem Kopf oder Wirbelsäule haben keine Schrumpfung gezeigt. Aber, wenn die AKN so bleiben wie sie jetzt sind mit Hilfe des Avastin, reicht es mir auch. Die Frage ist nur wie lange man Avastin nehmen kann oder wie der Verlauf aussieht, wenn man es eine zeitlang absetzt und später wieder anfängt. Das ist alles noch in der Testphase und muss ausprobiert werden.
Anna: Ziel der Therapie war, das Tumorwachstum zumindest zu stoppen, im Idealfall sogar die Tumoren zum schrumpfen zu bringen. Das Hörvermögen sollte sich dadurch auch stabilisieren bzw. verbessern.
Wolf: Ziel ist die Größenreduktion von Akustikusneurinomen sowie eine damit einhergehende Verbesserung des Hörvermögens, sofern Restgehör vorhanden ist. Verlässliche Daten für eine mögliche Progredienz des Tumorwachstums nach einer Avastin-Therapie gibt es derzeit noch nicht. In meinem Fall ist der Tumor nach Absetzen der Therapie wieder angewachsen. Nach Wiederaufnahme der Medikation war aber wieder eine Verkleinerung des Tumors zu verzeichnen.
Tom : Ich hoffe sehr auf eine dauerhafte Verkleinerung meiner ANs, damit ich mein Restgehör behalten, vielleicht sogar wieder etwas besser hören kann.
Suse: Das Ziel wäre gewesen, dass meine Ans schrumpfen und mei Restgehör wieder besser wird. Leider hat es bei mir nicht funktioniert.
Max: Da ich schon ertaubt bin war das Ziel, den Hirnstamm zu entlasten (anstatt wie bei den meisten, das Gehör zu erhalten bzw zu verbessern). Diese Entlastung ist nun zum Teil eingetreten, was wahrscheinlich auch meine immense Verbesserung der körperlichen Verfassung erklärt. Momentan nehme ich Avastin seit über 2 Jahren, solange mein Befinden stabil bleibt gibt es keinen Grund Avastin abzusetzen. Demnächst wird aber eine Pause eingelegt, weil kleinere Ops anstehen und Avastin vorher abgesetzt werden muss (wegen verzögerter Wundheilung).
Alles in allem, war es für dich die richtige Entscheidung, eine Avastintherapie zu beginnen und würdest du sie empfehlen?
Mia: Für mich war es die richtige Entscheidung. Schon allein der Erfolg, dass ich wieder besser hören kann, Gespräche wieder problemlos führen kann, hat mein Selbstbewusstsein und meine Lebensfreude in Schwung gebracht.
Empfehlen würde ich es jedem, wenn es bei ihm ratsam ist.
Anna: Ich denke, es war die richtige Entscheidung, die Therapie zu versuchen. Einfach schon deshalb, weil ich keine Alternative hatte, wenn ich mein Gehör erhalten wollte. Und es hätte ja auch funktionieren können!
Viele andere, die mit Avastin behandelt wurden, haben ganz tolle positive Erfahrungen gemacht und deshalb würde ich diese Therapie trotzdem empfehlen!
Wolf: Avastin stellt in einigen Fällen eine Alternative zur Operation dar, bietet u.U. größere Chancen auf Hörerhalt und sollte daher zumindest in Erwägung gezogen werden. Die möglichen Nebenwirkungen sollten mit möglichen Operationskomplikationen abgewogen werden. Nach meiner Erfahrung sowohl mit Operationen als auch der Avastin-Therapie würde ich persönlich künftig letztere präferieren.
Tom: Ja, es war auf jeden Fall die richtige Entscheidung für mich.Meine Erfahrungen in der Tübinger neurochirurgischen Ambulanz sind allerdings nicht gut, es ist chaotisch dort. Ich fühle mich nicht engagiert behandelt.
Ich würde beim nächsten Mal den weiten Anfahrtsweg plus Übernachtung vorziehen und nach HH-Eppendorf zu Prof. Mautner fahren.
Suse: Ich bin durch meine Erfahrungen eher skeptisch. Ich kann nur abraten, eine Avastin-Therapie auf eigene Kosten zu beginnen und dafür Schulden zu machen. Avastin ist noch zu wenig erforscht.
Max: Diese Therapie zu beginnen war für mich die beste Entscheidung meines Lebens und daher kann ich sie nur empfehlen! Ich wünsche allen NF2-Patienten, die so eine Therapie beginnen, dass sie zu den 75% gehören, denen Avastin hilft.
Einen weiteren Erfahrungsbericht zu Avastin finden Sie hier.

Mikrochirurgie
In der Therapie von primären Hirntumoren sollte erst bei fortschreitendem Tumorwachstum eine chirurgische Entfernung in Erwägung gezogen werden. Vestibularisschwannome z.B. werden so zunehmend frühzeitig hörerhaltend operiert, weil in frühen Stadien die Chance der Erhaltung des Hörvermögens auf der betroffenen Seite höher ist.
Große, den Hirnstamm komprimierende Tumoren mit oder ohne Liquorzirkulationsstörung können allerdings eine neurochirurgische Notfallsituation darstellen. Auch rasch wachsende Tumoren oder solche, die bereits zu Funktionsschädigungen eines Nerven geführt haben, erfordern schnelles Handeln. Dabei sind Aufrechterhaltung der Lebensqualität sowie Erhaltung der nervalen Funktionen das Wichtigste.
Zu den etablierten Standardverfahren zählen die mikrochirurgische Resektion, die Strahlentherapie und inzwischen auch die Chemotherapie. Einige Chemotherapieprotokolle nehmen eine noch nicht endgültig definierte Stellung ein und scheinen nur für Untergruppen von Patienten von einem tatsächlichen Vorteil zu sein..
Die mikrochirurgische Resektion wird bei Hirntumoren durchgeführt, welche ohne schwere Schädigung der umgebenden Hirnstrukturen erreicht und entfernt werden können. Liegt der Tumor in einer sehr funktionsreichen (eloquenten) Region, kann unter Umständen eine Operation auch einmal nicht sinnvoll sein.
Jede Intervention muss ein klar definiertes Ziel haben. Die wichtigsten Ziele der neurochirurgischen Resektion eines primären Hirntumors sind folgende:
- Versuch einer kurativen Therapie (=Heilung durch Entfernung; nur bei niedriggradigen Tumoren möglich).
- Beseitigung druckbedingter neurologischer Defizite (z.B. Lähmungen)
- Maximal mögliche Verringerung von Tumormasse zur Verbesserung der Ausgangssituation für weitere Behandlungen und zur Verminderung von späteren Nebenwirkungen (z. B. Hirnödem).
- Entfernung eines Rezidivtumors, wenn alle anderen Behandlungen nicht mehr wirken oder ausgeschöpft sind.
An dieser Stelle soll betont werden, dass es nicht zielführend für eine Behandlung sein kann, zu operieren was man sieht – weil es nun mal da ist.
Dem Neurochirurgen stehen für die Tumorentfernung mehrere spezialisierte Werkzeuge zur Verfügung, z. B. solche zur minimal-invasiven Resektion von Tumorgewebe, zur Anfertigung von Bildern während der Operation (intraoperatives MRT, CT, Intraoperative Ultraschallverfahren zur Echtzeitdarstellung, zur Navigation (s. übernächsten Absatz), zur Anfärbung von Tumorzellen (z.B. mit Aminolävulinsäure = ALA) und zum Monitoring von wichtigen physiologischen Hirnfunktionen im wachen Zustand und unter Narkose.
Zusätzlich erlaubt die chirurgische Tumorresektion die Gewinnung von ausreichenden Mengen einzufrierenden Tumorgewebes für molekularbiologische Untersuchungen, für Zellkulturen zur Testung der biologischen Eigenschaften des Tumors und eventuell für immunologische tumorzellbasierende Verfahren, z. B. Tumor“impfung“.
Eine weitere technische Entwicklung ist die so genannte dreidimensionale (3D)-Neuronavigation. Jedes Neuronavigationsgerät stellt ein computerisiertes rahmenloses dreidimensional arbeitendes System dar, welches die Lage chirurgischer Instrumente relativ zum Patienten und zu funktionell wichtigen Geweben während der OP darstellen kann. Als bildgebende Verfahren währen einer Operation stehen die intraoperative Kernspintomografie oder Ultraschallverfahren zur Verfügung (Echtzeitdarstellung).
Im Zusammenhang mit der Neurofibromatose Typ 2 soll natürlich zunächst vor Allem auf die mikrochirurgische Entfernung von Vestibularisschwannomen eingegangen werden. Vestibularisschwannome werden zunehmend frühzeitig operiert, weil in frühen Stadien die Chance der Erhaltung des Hörvermögens auf der betroffenen Seite höher ist.
Die Abbildung zeigt den Blick in den linken Kleinhirnbrückenwinkel nach Entfernung eines Vestibularisschwannoms. Rechts unter einem Spatel liegt das Kleinhirn. Die Stimulationspinzette liegt am Gesichtsnerv (N. facialis). Darüber sieht man auf den IV. und V. Hirnnerven und das Kleinhirnzelt, darunter auf den Hörnerven und die Gruppe der Schlucknerven. Links begrenzt das knöcherne Felsenbein mit dem inneren Gehörgang den Kleinhirnbrückenwinkel.
Die mikrochirurgische Operation eines Vestibularisschwannomes kann über unterschiedliche Zugangswege erfolgen - entweder über einen subtemporalen, translabyrinthären, oder suboccipitalen (bzw. retrosigmoidal) Zugangsweg.
Darüber hinaus sind eine Reihe von kombinierten Zugänge beschrieben worden. Die Wahl des operativen Zugangsweges hängt in erster Linie von der Tumorgröße ab. Dazu werden die Tumoren in verschieden Stadien eingeteilt, was sich auch als hilfreich für die Prognose des Krankheitsverlaufes oder zur Bewertung der OP Ergebnisse erwiesen (Qualitätskontrolle) hat.
- Intrameatale Vestibularisschwannome (T1 Tumoren) sind auf den inneren Gehörgang beschränkt. Sie werden durch cochleo-vestibuläre Ausfälle und selten durch eine zusätzliche Fazialisparese gekennzeichnet. Intrameatale Vestibularisschwannome werden meist auf dem subtemporalen Weg durch die mittlere Schädelgrube entfernt. Dieser Zugangsweg wird von HNO-Chirurgen bevorzugt.Die Operation wird am liegenden Patienten durchgeführt. Der Kopf ist dabei weit nach hinten/unten gestreckt. Oberhalb des Ohres wird die Kopfhaut eingeschnitten, ein Knochenstück aus dem Schläfenbein ausgefräst, so dass der obere Gleichgewichts-Bogengang sowie der innere Gehörgang offen sind. Es besteht damit eine gute Übersicht über die Gesichts- und Hörnerven. Der Gleichgewichtsnerv wird bei diesem Eingriff durchtrennt. Bevorzugt wird, wenn Tumorgröße und -lokalisation es zulassen, der subtemporale Zugang, da selbst bei Ertaubung der Nervenstrang noch für das Einsetzen eines so genannten Cochlear Implants zur Verfügung steht.
- Intracranielle Vestibularisschwannome (T2 Tumoren) mit max. Durchmesser bis zu 2,5 cm: Diese Tumoren rufen trotz ihrer Ausdehnung in den Kleinhirnbrückenwinkel nur otologische (HNO) Symptome hervor, die sich kaum von denen der intrameatalen unterscheiden.Der Zugang der Wahl ist transmastoidal oder translabyrinthär.
- Der translabyrinthäre Zugangsweg empfiehlt sich erst bei bereits erloschenem Gehör, das Labyrinth zerstört wird. Dennoch bietet dieser Zugang eine bessere Übersicht bietet da keine Hirnstrukturen komprimiert werden müssen. Der Warzenfortsatz wird aufgebohrt, der innere Gehörgang aufgesucht und das Neurinom ausgeschält.
Intracranielle Vestibularisschwannome mit Ausdehnung in den Kleinhirnbrückenwinkel hinein bis hin zum Hirnstamm (T3 Tumoren). Sie rufen immer Nachbarschaftssymptome v. A. vom n.trigeminus hervor (fehlender Cornealreflex, Hypästhesie der betroffenen Gesichtsseite). Diese Tumoren werden dem mit der Mikrochirurgie vertrauten Neurochirurgen überlassen, der sie auf dem suboccipitalen oder dem retrosigmoidalen Weg angehen wird.
Intracranielle Vestibularisschwannome (T4 Tumoren), die den Hirnstamm bereits verdrängen und daher eine neurochirurgische Notfallsituation darstellen können.
Der suboccipitale (retrosigmoidale) Zugang ist der typische für Neurochirurgen und wird bei mittlerem und großem Akustikusneurinom bevorzugt gewählt. Bei Tumoren, die weit in die hintere Schädelgrube gewachsen sind und Kleinhirn und/oder Stammhirn bedrängen, ist er zwingend. Auch hier sind die Erhaltung eines Hörvermögens möglich und eine Fazialisparese vermeidbar.
Dafür wird am Hinterkopf, hinter dem Ohr, die Haut aufgeschnitten (s. Abb.). Es wird ein Knochendeckel aus der sog. Hinterhauptsschuppe entfernt und die harte Hirnhaut geschlitzt. Bei seitlicher Lagerung des Patienten sinkt das Kleinhirn so weit zurück, dass der Gehörgang freiliegt. Die Operation erfolgt allerdings typischerweise in einer (halb-)sitzenden Position (diese Art der Lagerung bringt gerade bei größeren Tumoren bessere Behandlungsergebnisse), die eine besonders gute Sicht der empfindlichen Nervenstrukturen ermöglicht. Außerdem besteht ein Vorteil darin, dass sowohl Blut als auch Wasser nach unten laufen und der Operateur so stets beide Hände frei hat, um den Tumor vom Nerven abzuzupfen.
Bei senkrechter Lage des Patienten muss das Kleinhirn vorsichtig beiseite geschoben werden, um das Akustikusneurinom in der hinteren Schädelgrube freizulegen, zu identifizieren. Blutgefäße, die Teile des Gehirns versorgen, können in Tumornähe liegen und können erhalten werden.
Der Tumor wird zuerst von innen her verkleinert, zumal es sich in aller Regel um größere Tumore handelt. Der in der Schädelgrube gelegene Tumoranteil wird zuerst entfernt. Danach wird ggf. der innere Gehörgang aufgefräst und der dort lokalisierte Anteil ebenfalls entfernt.
Mit speziellen Mikroinstrumenten, Ultraschallzertrümmerern, elektrischer Verödung und Verdampfung, Laser oder Saugkanülen können die Tumore entfernt werden. Gefäßfehlbildungen werden mit Titanclips verschlossen oder mit verschiedenen Materialien ummantelt. Außerdem kann man durch die sogenannte „Stereotaxie“ mit Hilfe von Computerplanung und kleinen Instrumenten Tumorgewebe entnehmen (=Biopsie), welches dann für diagnostische Zwecke verwendet werden kann. Normales Hirngewebe wird bei der Stereotaxie durch den geringen Durchmesser der Führungskanülen und der stereotaktischen Instrumente kaum beeinträchtigt. Außerdem kann man mit der gleichen Methode Strahlenquellen in den Tumor einsetzen oder den Tumor von außen her sehr gezielt bestrahlen (stereotaktische Radiotherapie, Radiochirurgie).
Die „Neuroendoskopie“ hilft bei Operationen zur Tumorentfernung oder zur Biopsie in natürlichen Hohlräumen (z.B. Hirnkammern).
Eine weitere technische Entwicklung der letzten Dekade ist die sogenannte dreidimensionale (3D)-Neuronavigation. Jedes Neuronavigationsgerät stellt ein computerisiertes, rahmenloses System dar, welches die Lage chirurgischer Instrumente relativ zum Patienten und zu funktionell wichtigen Geweben während der OP dreidimensional auf den vor oder während der Operation gewonnenen Bilddaten darstellen kann. Diese Bilddaten können neuerdings auch Faserdarstellungen der Nervenbahnen (Diffusion Tensor Imaging, DTI) oder funktionelle Daten (z.B. Lage der Bewegungs-, Seh- und Sprachzentren ) enthalten.
„Brain Mapping“ ist der Oberbegriff für das Monitoring wichtiger Funktionen zur Differenzierung zwischen Tumor und funktionierendem normalen Hirngewebe. Zum Brain Mapping gehören im Wesentlichen die elektrophysiologischen Verfahren (z.B. somatosensorische evozierte Potentiale = SSEP), das intraoperative Elektroenzephalogramm (EEG), das Sprachmapping bei Operationen am wachen Patienten und das funktionelle intraoperative MRT. Testphase. Die orthogonale Darstellung der digitalen Bilddaten ermöglicht zudem heute auch eine Operationsplanung durch Visualisierung der anatomischen Bezugspunkte, die den Einsatz von Navigationssystemen gestattet.
Gerade das elektrophysiologische Monitoring (IOM) der Funktionen der Hirnnerven (siehe Abb. 3) können die exakte Operationsplanung und den Eingriff selbst unterstützen und so das Operationsrisiko minimieren. Das IOM gewinnt so aufgrund der Möglichkeit einer permanenten Überwachung und damit der Verbesserung der Ergebnisqualität einer Operation an Bedeutung.
Einen Weg zur Verbesserung der Tumorkontrolle erhofft man sich derzeit auch von experimentell entwickelten und auf molekularen und zellbiologischen Besonderheiten der Gliomzellen basierenden Verfahren. Alle diese Methoden (z. B. Gentherapie, Immuntherapie, rezeptorgesteuerte Toxintherapie, Signaltransduktionsblockade, Hemmung der Gefäßneubildung etc.) befinden sich noch in einer relativ frühen Testphase.
Die Chance für einen Funktionserhalt des Gehörs ist grundsätzlich am Größten, solange vor der Operation noch ein gutes Gehör vorhanden ist. Letztendlich aber wird der Erfolg eines chirurgischen Eingriffs genauso von anderen Faktoren bestimmt, z.B. Gefäßversorgung, Grad intraoperativer Manipulation oder der Geschicklichkeit/Erfahrung der Chirurgen.
Da es bei der Operation nicht immer gelingt, alle in der Nachbarschaft liegenden Hirnnerven zu erhalten, stellt sich dabei die Frage nach dem notwendigen Opfer nervaler Strukturen, um klinischen Erfolg zu garantieren und dem Auftreten von Rezidiven vorzubeugen.
Bei einer teilweise Tumorentfernung kann es zwar zu weiter fortschreitendem Hörverlust kommen, doch in der Regel eröffnet diese Art der Therapie ein Zeitfenster, während dessen der Patient Lippenlesen oder Gebärdensprache lernen kann. Eine teilweise Tumorentfernung hat allerdings eine hohe Rezidivrate zur Folge.
Für die Planung komplexerer Operationen gibt es neue Technologien, deren Nutzen oft im Detail liegt. Gerade diese Details können für den Patienten Gewinn oder Verlust von Lebensqualität bedeuten – es lohnt sich daher, alle Informationsquellen vorab zu nutzen.
Über die klassischen Informationsquellen hinaus – die Erfragung einer genauen Krankengeschichte und die exakte körperliche Untersuchung – tragen neue MRT-(Kernspin-) Untersuchungen durch spezielle Darstellungen der Stoffwechselaktivität eines Tumors und der Durchblutung dazu bei, schon vorab Aussagen zur Art einer Raumforderung im Bereich des Zentralnervensystems zu treffen. Über die anatomische MRT-Bildgebung kann das funktionelle MRT (fMRT) helfen, funktionstragende Hirnareale, wie z.B. Bewegungs- und Sprachzentrum darzustellen. Man erfährt dadurch, inwieweit diese Areale durch Tumore oder andere Läsionen komprimiert, verschoben oder infiltriert werden. Das betrifft sowohl die Hirnrinde als auch die Faserbahnsysteme, die für die Vernetzung verschiedener Hirnanteile von Bedeutung sind.
Für den Neurochirurgen ist es wichtig im Rahmen der Planung einer Operation möglichst viele dieser Detailinformationen zu bündeln und in die Beratung des Patienten über eine mögliche Operation einfließen zu lassen. Nur so kann man dem Patienten mit einiger Sicherheit sagen, welche Risiken bestehen und mit welcher Wahrscheinlichkeit Nebenwirkungen auftreten können. Das Gespräch unmittelbar vor der Operation gewinnt dadurch an Inhalt – Ängste lassen sich ab- und gegenseitiges Vertrauen lässt sich aufbauen.
Alle durch die neuen bildgebenden oder auch elektrophysiologischen Verfahren gewonnenen Informationen lassen sich durch moderne computerunterstützte Operationsverfahren (Stichwort: Neuronavigation) in den Operationsablauf integrieren. Man kann während der Navigation Strukturen definieren, die in jedem Fall während der Operation geschont werden müssen, um zusätzliche neurologische Defizite bei den Patienten zu vermeiden.
Die konsequente intraoperative, neurophysiologische Überwachung durch Ableitung sensorisch und motorisch evozierter Potentiale erhöht die Sicherheit der mikrochirurgischen Resektion des Tumors. Eine direkte Stimulation der Hirnrinde und der im Marklager befindlichen Faserbahnensysteme hilft Regionen mit motorischer Funktion zu identifizieren und zu schonen.
Darüber hinaus kann man aber mit Erfahrung in diesen Stimulationstechniken das Ausmaß der operativen Resektion der Tumore verbessern und sehr nah an eloquenten Hirnarealen Tumore entfernen. Tumore im - oder in der Nähe des - Sprachzentrums können durch eine Überwachung der Sprachfunktion während der Operation bei wachen Patienten ebenfalls mit hoher Sicherheit entfernt werden. Zusätzliche Tests dienen der Verhinderung neuropsychologischer Störungen, die nach der Entfernung von Tumoren insbesondere in der dominanten Hirnhälfte (Hemisphäre) auftreten können.
Schließlich muss schon vor der Operation die unmittelbar anschließende Weiterversorgung des Patienten (z.B. auf einer Intensivstation) geplant werden. Nur so kann der Operationserfolg auch gesichert werden. Es muss die Voraussetzung geschaffen werden, postoperative Komplikationen rasch und sicher erkennen zu können. Anders als andere Organsysteme kann das Zentralnervensystem eine Störung (z.B. mangelnde Durchblutung, geringe Sauerstoffversorgung, Druck) nur kurzzeitig tolerieren. Eine frühe Erkennung von Komplikationen ermöglicht es aber, dauerhafte Schäden am Nervensystem in fast allen Fällen zu vermeiden.
Diffusion Tensor Imaging (DTI) basiert auf lokalen Informationen über die Struktur der weißen Substanz des Gehirns, welche durch Magnetresonsanztomographie (MRT) gewonnen werden kann. Diese Daten kann man auch während einer Operation über die Navigation in das Okular eines OP-Mikroskops einspielen.
Prof. Dr. med. Steffen Rosahl
Neurochirurgische Klinik
HELIOS Klinikum Erfurt
Nordhäuser Str. 74
D-99089 ERFURT
Phone:+49 361/781-2261
Fax: +49 361/781-2262
Überblick
Navigationsgeräte und Monitoring (IOM) der Hirnnervenfunktionen (siehe Abb. 3) unterstützen die exakte Operationsplanung und den Eingriff selbst und minimieren so das Operationsrisiko. Das IOM gewinnt vor allem aufgrund der Möglichkeit einer permanenten Überwachung der Funktionen der Nerven und damit der Verbesserung der Ergebnisqualität einer Operation an Bedeutung.
Das intraoperative Neuromonitoring bedient sich elektrophysiologischer Methoden (EEG/Elektroenzephalographie, Evozierte Potenziale, Elektromyogramm). Während der Operation wird fortlaufend die elektrische Aktivität der potentiell gefährdeten Hirn- und Nervenstrukturen über Elektroden abgeleitet und aufgezeichnet. Dazu nutzt man bei sensorischen Bahnen (z.B. Hörbahn) die Eigenschaften des Bahnsystems selbst, welches über eine Umwandlung akustischer Signale in elektrische Signale (in den Rezeptorzellen des Innenohres) ein wechselndes elektrisches Feld um sich herum erzeugt. Die Änderungen dieses sehr schwachen Feldes kann man mit geeigneten Verstärkern aufzeichnen und grafisch sichtbar machen.
Andere Nerven steuern Bewegungsfunktionen (Motorik): z.B. die Augenmuskeln (Hirnnerven II, IV und VI), den Kaumuskel (Hirnnerv V), die Gesichtsmuskulatur (Hirnnerv VII). Die mechanische Berührung dieser Nerven löst Aktionspotenziale aus. Dadurch werden Muskelfasern in den dem Nerven zugeordneten Muskeln bewegt. Bevor man eine Bewegung mit dem bloßen Auge sehen kann, kann man sie durch Aufzeichnung von elektrischen Muskelentladungen (EMG) auf einem Monitor sichtbar, bzw. auch hörbar machen.
Jede Irritation (zum Beispiel durch Spülflüssigkeit) des beim Monitoring überwachten Nerven äußert sich dann durch ein lautes Geräusch, wodurch der Operateur sofort gewarnt wird. Dadurch kann der Operateur den anatomischen Verlauf von Nerven identifizieren, die er zu diesem Zeitpunkt u.U. noch gar nicht sehen kann, weil sie durch einen Tumor bedeckt sind. Alternativ kann ein motorischer Nerv auch direkt durch einen winzigen Stromstoß stimuliert werden.
Dauert die Aktivität des Nerven nach der Irritation an („pathologische Spontanaktivität“), dann kann der Operateur das operative Vorgehen modifizieren. Bestimmte Formen der pathologischen Spontanaktivität sind mit einer funktionellen Verschlechterung des Nerven verbunden, andere wieder nicht.
Überwachen des Hörnerven
Der Einsatz des Neuromonitoring ist bei Operationen dann sinnvoll, wenn aufgrund der anatomischen Komplexität des Operationsgebietes oder irregulärer anatomischer Verhältnisse die Verletzung eines bestimmten Nerven möglich erscheint.
(F)AEP sind Frühe Akustisch Evozierte Potenziale (Synonym: BERA), eine elektrophysiologische Untersuchung, mit der man Schädigungsort und Schädigungsausmaß einer Hörminderung feststellen kann. Dabei wird das Ohr über einen kleinen Ohrlautsprecher mit Klickgeräuschen beschallt und so die Cochlea gereizt. Diese überträgt den Schallreiz in elektrische Nervenimpulse, die über den Cochlearis-Nerven an den Hirnstamm und dort über eine Verschaltung in den Hirnnervenkernen zur so genannten Hörrinde an die Gehirnoberfläche weitergeleitet werden. An jeder Station (Cochlea, Hörnerv, Hirnstamm) entstehen charakteristische elektrische Potenziale, die man über Nadel- oder Oberflächenelektroden hinter der Ohrmuschel oder auch im äußeren Gehörgang ableiten kann. FAEP werden wie beispielsweise EMG auch auf einem Bildschirm sichtbar gemacht. Auf Grund der Höhe der einzelnen Potenziale und ihrem Abstand voneinander kann man Aussagen über Art, Lokalisation und Ausmaß der Hörbahn-Schädigung machen.
Die Abbildung zeigt FAEP gemessen mit einer konventionellen Elektrode in der Kopfhaut (oben) und gemessen mit einer Elektrode direkt am Hirnstamm (unten) Je näher die Elektrode an den Generatoren der Potenziale liegt, desto größer sind die gemessenen Potenziale. Mit einer Elektrode am Hirnstamm erhält der Operateur bereits nach einer Sekunde eine gute Rückmeldung über den Zustand der unteren Hörbahn, mit Elektroden in der Haut dauert das etwa eine Minute
Mit dieser Methode werden die in der Cochlea, dem VIII. Hirnnerven und dem Hirnstamm auf akustische Reize hin entstehenden Antwortpotenziale gemessen. Nach Applikation eines Clicks erfolgt die Ableitung der Antwortpotenziale mit Hautelektroden: einer Vertexelektorde (Scheitel) und einer Referenzelektrode unter dem Ohr. Die innerhalb der ersten 10 msec nach Reizbeginn erfolgenden Antwortpotenziale werden während der Ableitungszeit summiert und auf einem Computerbildschirm oder Oszillographen sichtbar gemacht.
Bei gesunden Kontrollpersonen erhält man eine typische Kurve mit 5 Gipfeln (Peaks), die der Reihenfolge nach in etwa der Cochlea, dem N.vestibulocochlearis sowie der Hörbahn des Hirnstammes zugeordnet werden können (I + II N. cochlearis, III Nucleus cochlearis; IV + V weitere pontine Hörbahn). Der 5. Peak ist der Größte und oft auch diagnostisch Wertvollste. Bei Tumoren im Bereich des inneren Gehörganges kommt es zu Verlängerungen der Latenzzeiten, zu Seitendifferenzen, Änderung der III-V-Zeit, sowie einem Abflachen oder Verschwinden des 5. oder auch der vorgelagerten Peaks. Die Resultate werden auch durch die verwendeten Narkotika nicht beeinflusst.
Einsatz findet die BERA in der Diagnostik vieler entzündlicher, vaskulärer, traumatischer und neoplastischer Hirnstammläsionen, bei der Überwachung von Eingriffen in die hintere Schädelgrube, und bei der objektiven Audiometrie. Diese Untersuchung sollte daher wie erwähnt auch während einer Vestibularisschwannom-OP durchgeführt werden.
Überwachung des Gesichtsnervs
Bei Operationen von Akustikusneurinomen und anderen Tumoren im Kleinhirnbrückenwinkel ist neben dem Hörnerven die Funktion des N.fazialis (Gesichtsnerv), der u.a. die mimische Gesichtsmuskulatur innerviert, von herausragender Bedeutung. Die Erhaltung des natürlichen symmetrischen Gesichtsausdrucks und der kräftige Lidschluss zum Schutz des Auges stellen unverzichtbare neurologische Funktionen dar.
Die Abbildung zeigt der linken Gesichtsnerv (N. facialis) und seine funktionelle Anatomie (Grafik mit freundlicher Genehmigung von Dr. André Leblanc)
Die Fazialisnerv-Funktion kann man bei einem Patienten in Vollnarkose während einer Operation natürlich nicht auf Grund seiner Mimik überprüfen. Man behilft sich deswegen mit einem kontinuierlich abgeleiteten so genannten Elektromyogramm (EMG) aus der mimischen Gesichtsmuskulatur. Mit elektrischen Ableitungen aus dem Stirn-, Nasen- und Mundmuskel werden Muskelpotenziale abgeleitet und kontinuierlich aufgezeichnet. Bei größeren Raumforderungen kann der zu Beginn der Operation noch durch den Tumor verdeckte N.facialis durch Elektrostimulationen direkt identifiziert werden.
Dabei wurden auch spezifische EMG-Potenziale gefunden, die auf eine drohende Schädigung des N.fazialis hinweisen und somit eine frühzeitige prognostische Aussage über die Funktion bereits während der Operation erlauben. Die EMG-Muster können on-line einer detaillierten computergestützten Analyse unterzogen werden.
Die Abbildung zeigt Elektroden um das linke Auge (im M. orbicularis oculi) zum Monitoring des N. fazialis. Bei unübersichtlichen Verhältnissen, wenn der Fazialisnerv beispielsweise durch ein großes Vestibularisschwannom abgeplattet und aufgefasert wurde, kann man auch durch eine direkte elektrische Stimulation mit einer Reizpinzette den Fazialisnerven identifizieren.
Diese Maßnahmen senken das Risiko einer Lähmung des Nerven durch die Operation (postoperative Fazialisparese).
Bei Operationen von Tumoren im Bereich der sensorischen Nerven, des Hirnstamms oder der Hirnrinde droht eine postoperative Gefühlsstörung, bei Tiefensensibilitätsstörungen manchmal verbunden mit einer erheblichen Gangunsicherheit, Schwindel und Taumel. Dies ist oft vermeidbar, wenn die zugehörigen anatomischen Strukturen genau identifiziert werden können.
Somatosensorisch evozierte Potenziale ermöglichen eine Beurteilung sensorischer Nerven, die für Tastsinn, Lagesinn und Schmerzempfinden verantwortlich sind. Dabei werden beim Patienten mehrere Elektroden angebracht. An einer Reiz oder Stimulationselektrode werden wiederholt elektrische Reize gesendet. Verschiedene Elektroden sind am Weg des betreffenden Nervs bzw. der zugeordneten Bahnsysteme in Rückenmark und Gehirn angebracht und messen so die Laufzeit und Größe des bioelektrischen Signals (Etagendiagnostik). Trotz der niedrigen Reizstärke und damit Ungefährlichkeit der Stromstöße ist diese Methode nicht unter Umständen nicht für alle für Träger medizinischer Implantate geeignet.
Neben dem eigentlichen Monitoring besteht außerdem die Möglichkeit mittels neurophysiologischer Ableitungen und Elektrostimulationen am offenen Gehirn funktionell bedeutsame Strukturen zu lokalisieren und zu schonen. Dies ist eine wesentliche Erweiterung und Ergänzung zu den bildgebenden Verfahren mit Neuronavigation, zur intraoperativen Kernspintomographie (MRI) und zu den funktionellen Methoden des fMRI und MEG.
Prof. Dr. med. Steffen Rosahl
Neurochirurgische Klinik
HELIOS Klinikum Erfurt
Nordhäuser Str. 74
D-99089 ERFURT
Phone:+49 361/781-2261
Fax: +49 361/781-2262
Symptome im Kopf- und Halsbereich
Der Fazialis-/Gesichtsnerv innerviert die mimische Muskulatur (Mimik = Gesichtsaudruck) als ein wichtiges kommunikatives Instrument. Er ist auch wichtig für den Lidschluss und die Tränenbildung, und damit für die Benetzung des Auges zum Schutz sowie für einen kleineren Teil der Speichelsekretion und des Geschmacksempfindens auf der Zunge. Vorübergehend ist eine Gesichtsnervlähmung, wenn der Nerv in seiner Kontinuität und seiner Regenerationsfähigkeit erhalten bleibt. Bleibend ist die Lähmung, wenn er z.B. während der Entfernung eines Vestibularisschwannoms, durch eine Verletzung, einen Tumor oder auch durch eine Bestrahlung hochgradig geschädigt wird. Bei Operationen sind Tumorgröße, Sorgfältigkeit des Operateurs, Verwachsungen des Tumors mit Fazialisnerven, Gefäßversorgung und die Ausdünnung des Nerven wichtige Faktoren für den Funktionserhalt.
Bei Gesichtsnervlähmungen ist oft auch der Augenlidschluss nicht mehr vollständig möglich. Deshalb kann man bei Patienten mit dieser Lähmung beobachten, wie sich das Auge beim Versuch, beide Lider zu schließen nach oben dreht, so dass das Weiße sichtbar wird (ein normaler, physiologischer Reflex, den man als "Bell'sches Phänomen" bezeichnet). Versucht ein Patient mit einseitiger Fazialislähmung die Stirn zu runzeln, dann bleibt diese auf der betroffenen Seite glatt. Das öffnen des Auges ist dagegen auch weiterhin möglich.
Tritt eine Gesichtsnervlähmung (Fazialisparese) nach OP trotz erhaltener Kontinuität des Nerven auf, kann man in der Regel mit einer spontanen Erholung rechnen. In dieser Zeit muss aufgrund des inkompletten Lidschlusses die Augenbindehaut mit Augensalben und nachts mit einem so genannten Uhrglasverband vor Austrocknung und Bindehautentzündungen geschützt werden.
Tritt die Erholung aber nicht innerhalb von 6 Monaten ein, muss man eine Umpflanzung eines anderen Hirnnerven auf den Fazialisnerven in Erwägung ziehen. Dabei wird am häufigsten der Hypoglossusnerv, der die Zungenmuskulatur innerviert, verwendet. Diese Operation wird daher „hypoglosso-faziale Anastomose“ genannt. Dieser Eingriff wird in Vollnarkose am seitlichen Hals unter dem Unterkiefer durchgeführt, wo man beide Nerven in ihrem Verlauf außerhalb des Schädels auffinden und miteinander verbinden kann.
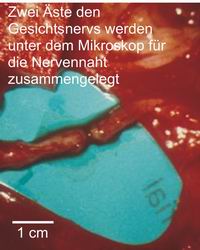
Ist während einer Entfernung eines Vestibularisschwannoms eine (Teil-) Durchtrennung des Fazialisnerven aufgetreten, wird nach Möglichkeit noch in gleicher Sitzung eine Rekonstruktion des Nerven durchgeführt, sofern dies die anatomischen Verhältnisse zulassen. Nach der Operation ist allerdings nicht mit einer sofortigen Funktionstüchtigkeit des Nerven zu rechnen, da seine Nervenfasern erst von der reparierten Schädigungsstelle aus mit einer Geschwindigkeit von 1 mm pro Tag (!) wieder aussprossen.
Zunächst ist eine direkte Naht des Nervs die Behandlung der Wahl. Besteht durch die Schädigung eine Lücke im Verlauf des Nervs, so verwendet man ein Nerventransplantat, das man in die Lücke einnäht. Als Spendernerv verwendet man entweder einen Gefühlsnerv vom Hals oder vom Bein. Die Entnahme dieser Spendernerven ist mit keinem wichtigen Funktionsverlust für den Patienten verbunden. Der Patient erleidet einen geringen Gefühlsverlust in der Entnahmeregion. Mit einer frühen Rekonstruktion durch eine direkte Naht oder ein Nerventransplantat erreicht man die besten Ergebnisse.
Die Regeneration verläuft langsam. Die Nervenregeneration dauert 6 bis 12 Monate, selten auch bis 18 Monate. Das bedeutet, dass der Patient solange mit Änderungen der Gesichtsfunktion rechnen darf. Mit einer direkten Nervenrekonstruktion oder einer Nerventransplantation erreicht man in der Regel wieder eine gute Ruhespannung der Gesichtsmuskulatur. Somit ist nach Abschluss der Regeneration in Ruhe bei den Patienten kein wesentlicher Unterschied mehr zur gesunden Gegenseite zu erkennen. In Bewegung wird ein ausreichender Augenschluss und Mundschluss erreicht. Mit der Wiederherstellung ausreichender emotionaler mimischer Möglichkeiten ist zu rechnen.
Oft ist es aber zunächst nicht sicher zu beurteilen, wie schwer der Gesichtsnerv verletzt wurde. Eine typische Situation nach der Entfernung eines Vestibularisschwannoms ist es, dass eine Gesichtslähmung vorliegt, der Nerv aber bei der Operation nicht wissentlich verletzt wurde. Erst nachdem der weitere Spontanverlauf abgewartet wurde, sich aber keine Besserung der Lähmung eingestellt hat, kommt der Verdacht auf, dass es sich um eine dauerhafte Lähmung handeln könne. Daher stellt sich nun die Frage, welche chirurgischen Maßnahmen sinnvoll sind, um dem Patienten mit bleibender Lähmung zu helfen. Typischerweise sind dann 6 - 18 Monate seit der Operation vergangen.
Liegt nur eine geringgradige Schädigung des Nerven vor, verliert das Gesicht oftmals nicht so ausgeprägt seine Ruhespannung, und die Beweglichkeit erholt sich wieder. Bei einer schwerwiegenden und dauerhaften Schädigung des Gesichtsnerven sind theoretisch zwei Verlaufsformen möglich, wobei es praktisch oft zu einer Mischung beider Verlaufsformen kommt.
Selbst in einem komplett durchtrennten Nerv ist ein Wiederaussprossen von Nervenfasern zu beobachten. Im schlimmsten Fall ist der durch die Schädigung entstandene Defekt jedoch so groß oder so vernarbt, dass die Nervenfasern ihn nicht mehr selbständig überbrücken können und die Gesichtsmuskulatur gar nicht mehr oder zu spät erreichen. In diesem Fall kommt es zu keiner Erholung der Ruhespannung der Muskulatur, das Gesicht bleibt schlaff, und es kommt natürlich auch zu keiner Erholung der Beweglichkeit der betroffenen Gesichtshälfte.
Häufiger ist zu beobachten, dass wieder Nervenfasern auswachsen und auch Kontakt zu mimischen Muskeln des Gesichts aufnehmen. Daher beobachtet man auch bei schweren Verletzungen des Gesichtsnervs 4 - 12 Monaten nach Auftreten der Lähmung Erholungszeichen wie eine verbesserte Spannung der Gesichtsmuskulatur oder sogar Bewegung im Gesicht. In manchen Fällen wird jedoch nie wieder - u.U. auch nicht annähernd - die ursprüngliche normale Funktion erreicht. Warum?
Bei einer unvollständigen Regeneration wachsen nicht wieder so viele Nervenfasern aus, wie ursprünglich vorhanden waren. Daher erreicht die Beweglichkeit des einzelnen Muskels nicht wieder die alte Stärke. Zum anderen können sich die auswachsenden Nervenfasern mehrfach teilen und zu Gesichtsmuskeln aussprossen, die sie vor der Lähmung gar nicht versorgt haben. Es kann auch sein, dass eine Nervenfaser, die z.B. vorher einen Muskel am Auge versorgt hat, nach der Regeneration in einen ganz anderen Muskel, z.B. am Mund einwächst.
Möchte der Patient nun zum Beispiel das Auge schließen, so wird er alle Nervenfasern über sein Gehirn aktivieren, die ursprünglich für den Augenschluss zuständig waren. Über die fehlgewachsenen Nervenfasern geht dieses Kommando nun an die Mundmuskeln. Dies führt dazu, dass der Patient geschwächt das Auge schließt und gleichzeitig ungewollt den Mund bewegt. Eine solche ungewollte Mitbewegung nennt man Synkinesie.
Besonders unangenehm ist der ungewollte Augenschluss bei Mundbewegungen, zum Beispiel beim Essen. Werden gleichzeitig zwei Muskel aktiviert, die eine gegenläufige Wirkung entfalten, wie zum Beispiel der Augenschließmuskel und der Stirnmuskel (ähnlich Beugern und Streckern am Bein), so heben sich die Bewegungen auf und es ist keine oder nur sehr schwache Bewegung zu sehen. Sprossen Nervenfasern des Auges, die ursprünglich zum Lidschlussreflex gehörten, zum Beispiel zum Mund aus, so kann dies zu einer rhythmischen Zuckung am Mund führen. Fehlaussprossungen von Fasern, die ursprünglich eigentlich für Speichelproduktion zuständig waren, in die Tränendrüse führen zum Augentränen (so genannte Krokodilstränen) beim Essen. Allgemein spricht man bei allen möglichen Folgen einer Fehlaussprossung von einer Defektheilung. Nach Auftreten von Defektheilungszeichen können sich diese noch für mindestens weitere 12 Monate verändern.
Eingeteilt wird eine Fazialisparese nach den Chirurgen William House und Derald Brackman (Los Angeles) unter Angabe des prozentualen Defizits. Die Übersichtstabelle kann hier heruntergeladen werden.
Die Fazialisnerv-Funktion kann man bei einem Patienten in Vollnarkose während einer Operation natürlich nicht aufgrund seiner Mimik überprüfen. Man behilft sich daher mit elektrophysiologischen Methoden, z.B. einem so genannten Elektromyogramm (EMG) der mimischen Gesichtsmuskulatur, bei dem über fixierte Nadelelektroden die elektrische Aktivität über Elektroden abgeleitet und aufgezeichnet wird. Die Änderungen kann man mit geeigneten Verstärkern aufzeichnen und grafisch sichtbar machen.
Auch durch eine direkte elektrische Stimulation mit einer Reizpinzette lässt sich der Fazialisnerv identifizieren. Schließlich ist es möglich, mittels magnetischer oder elektrischer Stimulation des Gehirns eine Nervenantwort auszulösen, die man an der zugehörigen Muskulatur kontinuierlich messen (monitoren) kann.
Prof. Dr. med. Steffen Rosahl
Neurochirurgische Klinik
HELIOS Klinikum Erfurt
Nordhäuser Str. 74
D-99089 ERFURT
Phone:+49 361/781-2261
Fax: +49 361/781-2262
E-Mail: neurochirurgie.erfurt@helios-kliniken.de
Nach längerer Zeit ist eine Wiederherstellung durch eine direkte Naht oder eine Nerventransplantation nur noch schlecht möglich. Empfehlenswerter ist dann eine so genannte Hypoglossus-Fazialis-Nervenanastomose. Dabei wird der gleichseitige Zungennerv durchtrennt und jenseits der Schädigungsstelle an den Gesichtsnerv angenäht. Dieses Verfahren wird auch zu einer sofortigen Rekonstruktion angewandt, wenn der Gesichtsnerv über eine so lange Strecke zerstört ist, dass eine Nerventransplantation nicht mehr möglich ist.
Die Hypoglossus-Fazialis-Nervenanastomose ist ein sehr sicheres Verfahren. Binnen 12 Monaten kommt es zu einer Erholung der Ruhespannung des Gesichtes und zu einer deutlichen Besserung der Beweglichkeit. Die Wiederherstellung der Gesichtsbeweglichkeit hat aber auch Nachteile. Manche Patienten klagen über starke Synkinesien. Zwangsläufig tritt zudem eine leichte bis im schlimmsten Fall deutliche Lähmung der gleichseitigen Zungenhälfte auf. Daher wird heutzutage die klassische Hypoglossus-Fazialis-Nervenanastomose dahingehend verändert, dass der Zungennerv nicht ganz durchtrennt, sondern nur gespalten wird, und so nur ein Teil des Nervs für die Wiederherstellung der Gesichtsbeweglichkeit genutzt wird (so genannte Hypoglossus-Fazialis-Jump-Nervenanastomose). In diesem Fall ist nur selten eine wesentliche Zungenlähmung zu beobachten.
Da weniger Nervenfasern zur Rekonstruktion zur Verfügung stehen, läuft die Erholung der Gesichtsbewegung langsamer ab - Veränderungen stellen sich bis 18 - 24 Monate nach Operation ein. Insgesamt ist die Gesichtsbeweglichkeit geringer als nach einer klassischen Hypoglossus-Fazialis-Nervenanastomose mit dem Vorteil, dass aber möglicherweise die Synkinesien geringer ausgeprägt sind. Nach einer Hypoglossus-Fazialis-Nervenanastomose muss der Patient durch eine intensive Übungsbehandlung lernen, durch (gedachte) Bewegungen der Zunge das Gesicht zu bewegen. Zunächst müssen sehr bewusst Zungenbewegungen vollführt werden, um eine Gesichtsbewegung zu erzeugen. Mit zunehmender Übung werden im besten Fall die Gesichtsbewegungen ohne bewussten Einsatz der Zunge vollbracht.
Eine solche Übungsbehandlung, dies gilt auch für die anderen Maßnahmen zur Rekonstruktion des Nervs, ergibt erst dann Sinn, wenn nach frühestens 6 Monaten wieder Nervenfasern in die Gesichtsmuskulatur ausgewachsen sind. Zuvor ist es natürlich unmöglich, durch gezielte Zungenbewegungen das Gesicht zu bewegen.
Alle oben dargestellten Wiederherstellungsmaßnahmen am Nerv haben den Nachteil, dass der Patient etwa weitere 12 -18 Monate warten muss, bis sich eine Gesichtsbewegung einstellt. Eine sofortige Wiederherstellung ist durch eine Muskelplastik möglich. Diese Operationsverfahren sind zudem empfehlenswert, wenn die Lähmung über 2 bis 3 Jahre her ist.
Nach einem so langen Zeitraum ist der Gesichtnerv narbig umgewandelt und auch die Gesichtsmuskulatur unwiederbringlich verkümmert, dass eine Nervenrekonstruktion nicht mehr sinnvoll ist. Es sind für diesen Fall dynamische Maßnahmen, bei denen wieder eine Beweglichkeit erzielt werden soll, von statischen Maßnahmen abzugrenzen, die ausschließlich zum Ziel haben wieder eine Ruhespannung im Gesicht zu erzeugen.
Mangelhafter Lidschluss ist das häufigste Augenproblem bei NF2-Betroffenen das infolge einer Gesichtsnervlähmung auftritt. Ursache ist ein so genannter Lagophthalmus, der als Folge einer Fazialisparese mit Lähmung des ringförmigen Musculus orbicularis oculi Auftritt. Der Patient kann eines oder beide Lider nicht mehr vollständig schließen. Dadurch kommt es zu einer Verbreiterung der Lidspalte. Der normalerweise geschlossene Tränenfilm reißt auf und die Hornhaut trocknet aus. (med. Sicca-Syndrom).
Ohne Behandlung entwickelt sich eine Hornhautentzündung oder sogar ein Hornhautgeschwür. Die große Gefahr dieses Geschwüres besteht in einer Verletzung des Augeninneren. Symptome dieser Hornhautschäden sind Blendempfindlichkeit, schlechtes Kontrastsehen oder unscharfes Sehen.
Eine Möglichkeit zur Behandlung schwerster Hornhautschäden ist das Aufnähen einer Amnionmembran, eines Häutchens aus der Gebärmutter, auf die Hornhaut. Die Membran bleibt drauf, löst sich innerhalb von ca 3 Wochen auf und gibt dabei wertvolle Nahrung an die Hornhaut ab. Eine komplette Heilung ist damit zwar nicht möglich, aber eine Verbesserung.
Die Augenoberfläche wird normalerweise durch einen regelmäßigen Tränenfilm befeuchtet und geschützt. Weitere Aufgaben des Tränenfilmes bestehen in der Hornhauternährung sowie der regelmäßigen Desinfektion. Fehlt dieser Tränenfilm oder ist er mangelhaft ausgebildet, können daraus schwere Krankheitsbilder mit Sehstörungen/Sehverschlechterung oder Zerstörung der Hornhaut resultieren.

Durch regelmäßiges Blinzeln wird die Tränenflüssigkeit gleichmäßig über das Auge verteilt. Sie enthält nicht nur Wasser, sondern viele Nahrungsbestandteile und Sauerstoff für die Hornhaut, sowie Abwehrstoffe gegen eindringende Fremdstoffe und Keime. Der Schleim aus der Bindehaut hält die Flüssigkeit auf dem Auge, aus den Drüsen am Lidrand werden wichtige Fettsubstanzen zur Stabilisierung der Tränenflüssigkeit beigegeben, die eine zu rasche Verdunstung verhindern.

Bei Patienten mit trockenem Auge wird die Hornhaut nicht mehr ausreichend mit Feuchtigkeit benetzt. Verursacher des trockenen Auges können neben dem unten beschriebenen Lagophthalmus Erkrankungen des rheumatischen Formenkreises sein, die aber in Zusammenhang mit der NF eher selten auftreten, oder das so genannte Sjögren Syndrom, eine Schädigung der Tränendrüse.
Weitere Symptome
Weitere Symptome reichen von einem Druckgefühl am Auge über ein Kratzen, Stechen oder Sandgefühl, eben das Gefühl von Trockenheit, bis hin zu einfach müden Augen. Genauso kann es sein, dass die Hornhaut der Tränendrüse meldet: "zu trocken", und diese infolgedessen mehr Flüssigkeit produziert, die aber zu dünn ist und nicht auf dem Auge hält. Dieses Phänomen wird "paradoxes Tränen" genannt, d.h. obwohl das Auge tränt, ist es eigentlich eher zu trocken.
Auch Lichtempfindlichkeit ist ein klassisches Symptom der ausgetrockneten Hornhaut. Häufig ist deren Oberfläche dann bereits wund, was sich auch in Sehverschlechterung äußern kann. Der von allen so gefürchtete Augendruck steigt allerdings eher selten. Er ist aber äußerst gefährlich, weil er für den Betroffenen selber nicht zu bemerken ist und erst bei extremem Anstieg auf über 35 mm/Hg Schmerzen .
Therapie
Als operatives Verfahren der Wahl zur Verbesserung des Lidschlusses ist die Implantation von Gewichten in das Oberlid (Lidloading) zu nennen. Der Trick dabei ist, dass das Gewicht das Lid schließt (funktioniert deshalb nur in der Vertikalen, nicht im Liegen). Die Bewegung des Lid-Öffners ist nicht Funktion des Fazialis, sondern des Trigeminus-Nervs. Man muss nicht lernen, die Augen zu öffnen statt zu schließen, das geht automatisch.
Seit 1999 stehen flexible Platinketten (Platin ist sehr gut verträglich und als Edelmetall nicht magnetisch, aber Achtung: es werden auch starre Platingewichte verwendet) für das Lidloading zur Verfügung. Es ist zwar noch nicht vollständig geklärt, inwieweit die starren Implantate den flexiblen unterlegen sind, aber schon jetzt lässt sich sagen, dass die flexiblen Implantate den anatomischen Gegebenheiten des Oberlides besser gerecht werden können.
Auch heute noch werden ebenfalls starre Goldgewichtimplantate verwendet. Je nach Grad der Hornhautschädigung kann auch eine Lidrandnaht (Tharsorrhapie) hilfreich sein, ein temporärer operativer Teilverschluss der Lidspalte, meist in Verbindung mit einer Straffung des Unterlides. Diese Unterlidstraffung wird ebenfalls in Verbindung mit Lidloading angewendet, um das notwendige Gewicht der Lidimplantate richtig bestimmen zu können.
Zur Behandlung des Lagophthalmus kommen außerdem Tränenersatzflüssigkeit oder Salben (Salben für die Nacht, Gels und Tropfen/Tränenersatzmittel tagsüber). zum Einsatz, die das Austrocknen des Auges verhindern sollen. Auch weiche Kontaktlinsen oder Uhrglasverbände zur Nacht können das Austrocknen des Auges vermindern, v.a. bei mangelndem Lidschluss in der Nacht. In der Nacht bleibt das Auge sonst offen stehen, wird dann nach oben verdreht und das Weiße des Augapfels sichtbar (als ineffektiver Versuch des forcierten Augenschlusses = Bell´sches Phänomen) .
Eine weitere Möglichkeit besteht in der Regulierung des Tränenabflusses. So gibt es seit einiger Zeit Kunststoff-Stöpsel („punctum plugs“), die wie ein Ventil wirken: Ist wenig Tränenflüssigkeit im Auge, bleibt der Kanal zu, kommt viel, fließt über die Kapillarwirkung Tränenflüssigkeit ab (bevor es zum Tränenträufeln kommt).

Die Tränenflüssigkeit verbleibt dadurch länger auf dem Auge.
Auch vorbeugende Maßnahmen sind in der Therapie des trockenen Auges notwendig. So sollte man vorbeugend Zugluft sowie überheizte oder verrauchte Räume vermeiden und unbedingt Luftbefeuchter benutzen. Wichtig ist genauso das Trinken von genügend Flüssigkeit. Bewährt haben sich auch im Zusammenhang mit einem durch eine Fazialisparese hervorgerufenen trockenen Auge (da kein ständiges Blinzeln möglich ist) das Tragen entweder von Uhrglasverbänden, Brillen mit anatomischem Seitenschutz oder von Kontaktlinsen als Verbandslinsen.
Augentropfen, die gefäßverengende Substanzen oder Cortison enthalten, sollten nur nach ärztlicher Anweisung verwendet werden, da sie die Symptome sonst nur verschlimmern und sind nur in Einzelfällen als Entzündungstherapie nach einer Fazialisparese sinnvoll.
Für die Betroffenen bleibt daher wichtig, die Augen immer vor Wind, Sonne und Kälte zu schützen. Gletschersonnen- oder Schwimmbrillen können hilfreich sein.
Hierbei wird einer der gleichseitigen Kaumuskeln von seiner normalen Position verlagert und im Mundwinkel aufgehängt. Dies sorgt sofort wieder für eine Spannung im Mundbereich. Am Auge sind die Ergebnisse nicht so gut, so dass meist auf eine Aufhängung am Auge verzichtet wird. Nach einer solchen Muskelplastik muss der Patient lernen, durch Kaubewegungen das Gesicht zu bewegen.
Da bei dieser Operation nur Muskeln versetzt werden, kann unmittelbar nach Abschluss der Wundheilung mit der Übungsbehandlung begonnen werden. Die Ergebnisse sind nicht so gut wie nach einer Nervenrekonstruktion. Die Bewegung des Mundes bleibt im Vergleich zur normalen Funktion wesentlich gröber. Auf jeden Fall kann mit einer solchen Maßnahme verhindert werden, dass dem Patienten zum Beispiel weiter beim Essen unkontrolliert Flüssigkeit aus dem Mund läuft.
Anstatt einer Muskelverlagerung kann auch kräftige Muskelhaut von Oberschenkel-Beinmuskeln oder eine Sehne eines Unterarmmuskels wie ein Zügel zwischen Mundwinkel und Wangenknochen aufgespannt werden. Hiermit erzielt man sofort eine gute Ruhespannung des unteren Gesichts. Eine verbesserte Bewegung des Gesichtes tritt nicht ein.
Die genannten chirurgischen Behandlungsmöglichkeiten sind die am häufigsten eingesetzten Verfahren. Daneben gibt es noch eine Vielzahl kleinerer operativer Eingriffe, die im Einzelfall ergänzend eingesetzt werden.
Die Krankengymnastik hat eine große Bedeutung sobald die ersten Bewegungen nach einer Nervenrekonstruktion eintreten. Eine intensive Übungsbehandlung verbessert das endgültige Ergebnis dauerhaft. Werden ausschließlich Muskelplastiken vorgenommen, so kann mit der Übungsbehandlung unmittelbar nach Abschluss der Wundheilung begonnen werden. Die Reizstrombehandlung wird kontrovers diskutiert, der Vorteil besteht aber darin, dass die Gesichtsmuskulatur wieder aufgebaut wird.
Als unterstützend anzuwendendes medikamentöses Verfahren kann man das Medikament Botulinum-Toxin A in die Augenschluss-Muskulatur einspritzen, um die überschießende Aktivierung des Muskels zu schwächen und die Synkinesien zu mildern. Die Wirkung des Medikaments hält etwa vier Monate an und muss dann wiederholt werden. Klagt der Patient über Krokodilstränen, so kann Botulinum-Toxin A auch in die betroffene Tränendrüse gespritzt werden. Durch diese Maßnahme wird die Tränenproduktion für etwa ein Jahr verringert.
Den kompletten Text zum Thema "Fazialisrekonstruktion" können Sie hier herunterladen.....
(Facialisreha Teil 1) (Facialisreha Teil 2)
Das Auge nimmt in der Behandlung von Fazialisparesen eine Sonderstellung ein. Wichtig ist bei unvollständigem Lidschluss der Schutz der Hornhaut vor Austrocknung. Dazu dienen nachts Uhrglasverbände oder Augensalbe, sowie tagsüber Benetzung mit künstlichen Tränen, und evtl. auch eine Seitenschutzbrille. Elektrotherapie soll Fehlinnervationen begünstigen. Übungen zur Verbesserung der Regeneration nach axonaler Schädigung scheinen jedoch eine sinnvolle und wirksame Alternative zu sein. Zu beachten ist dabei allerdings, dass es mit Gesichtsübungen auch nicht übertrieben werden darf, da dadurch die Ausbildung von Asymmetrien begünstigt werden kann. Vorschläge für solche Übungen können Sie hier herunterladen.
Die einfachste Möglichkeit, das Auge zu schützen, besteht im Tragen eines Uhrglasverbands. Dies wird von vielen Patienten auf Dauer als sehr störend empfunden. Zudem kann hiermit eine Augenentzündung nicht sicher verhindert werden. Das operative Verfahren der Wahl zur Wiederherstellung des Augenschlusses ist in Deutschland das Einsetzen eines Gewichtes ins Oberlid. Dieses Gewicht wird in einer lokalen Betäubung in das Oberlid eingenäht. Durch das Gewicht wird das Auge passiv geschlossen. Das Öffnen des Auges bleibt weiter möglich, da es einen Augenöffnungs-Muskel gibt, der nicht vom Gesichtsnerv gesteuert wird und der regelrecht funktioniert. Die Operation ist kurz und risikoarm. Ein Gewicht kann auch im Rahmen der anderen oben genannten Operationen eingesetzt werden; kommt es dann zum Beispiel nach einer Nervenrekonstruktion zu einer Erholung der Augenschluss-Muskulatur, so kann das Gewicht problemlos wieder entfernt werden.
Eine Übersicht über die Behandlungsmöglichkeiten der Fazialisparesen können Sie sich hier herunterladen.
Der Schluckakt
Als Schluckstörung (Dysphagie) wird eine Störung des Schluckaktes bei der Nahrungsaufnahme oder beim Schlucken des eigenen Speichels bezeichnet. Sie tritt auf, wenn eine der am Schluckakt beteiligten Strukturen in ihrer Funktion bzw. deren Zusammenwirken beeinträchtigt ist. Die Dysphagie ist eine schmerzlose Schluckstörung.
Der Schluckakt verläuft im Normalfall weitestgehend reflexgesteuert. In der Mundhöhle wird zunächst die Nahrung zerkleinert und durch Vermischen mit Speichel gleitfähig gemacht. Anschließend erfolgt die Speisenbeförderung über die Hinterzunge in den Rachenraum. Bis hierhin kann der Schluckvorgang noch willentlich unterbrochen werden. Die Berührung mit den Gaumenbögen löst dann den eigentlichen Schluckreflex aus. Die Hauptvoraussetzung für einen ungestörten Schluckablauf ist der einwandfreie Abschluss der Atemwege, die sich mit den Speisewegen im Rachen kreuzen. Das Gaumensegel verschließt den Nasenraum von hinten und der Kehlkopfdeckel den Kehlkopfeingang und damit die Luftröhre. Auch eine Funktion des Kehlkopfdeckels liegt darin, die Luftröhre vor Speisestücken zu schützen, indem beim Schluckakt der Kehlkopf nach vorn gezogen wird.

Bestimmte Nerven geben dem Gehirn Rückmeldung z.B. über Geschmack und Geruch der Nahrung, Informationen über die Beschaffenheit der Speise, die auf der Zunge liegt (...muss erst gekaut werden oder kann ich sofort schlucken...) oder z.B. auch darüber, ob sich in den Wangentaschen noch Reste vom Schokoladenkeks befinden.
Bei NF2 treten Schluckstörungen in der Regel nach Entfernung eines Vestibularisschwannnomes häufig auf. Der n.glossopharyngeus nämlich innerviert die Zunge und den Rachenraum. Eine Schädigung des Nervus glossopharyngeus oder eine Lähmung des n. recurrens führt zu einer Lähmung der Schlundkopfmuskeln und damit zu Schluckstörungen. Schluckstörungen können aber auch psychische Ursachen haben, die man v.a. bei jungen Patienten mit wechselnden Beschwerden annehmen kann. Wenn der Patient meint, "nicht alles schlucken" (sich nicht alles gefallen lassen) zu können, zwingt dies zur Abklärung der weiteren Lebensumstände.
Symptome einer Schluckstörung sind Druckgefühl im Hals, Würgen während des Schluckaktes bzw. Hochwürgen bereits geschluckter Nahrung oder Husten während einer Mahlzeit. Die Atemwege sind bei den Patienten oft schlecht geschützt so dass es während einer Mahlzeit auch zum Übertritt von Nahrung/Flüssigkeit in die Atemwege kommen kann. Die Folge dieser Aspiration können akute und wiederkehrende Lungenentzündungen (Aspirationspneumonie) sowie Fieber sein. Diese Art der Pneunomie ist z.B. bei Schlaganfallpatienten für 20 % der Todesfälle verantwortlich.
Folgen
Je nachdem welche Schluckphase betroffen ist, kann es auch zu ganz spezifischen Problemen kommen: Die Nahrungsaufnahme ist erschwert bis nicht möglich z.B. bei Patienten mit zusätzlicher Lähmung der Gesichtsmuskulatur.
Die Verarbeitung, die Kontrolle und der Transport der Nahrung aus der Mundhöhle in den Rachen sowie die Auslösung des Schluckreflexes sind verzögert bei schlechter Zungenbeweglichkeit, Schwäche der Wangenmuskulatur oder gestörter Empfindsamkeit der Schleimhaut. Als Begleitsymptome der Schluckstörungen können außerdem Heiserkeit oder eine näselnde Sprache auftreten. Im Weiteren Verlauf kommt es meist auch zu sozialer Isolation wegen Peinlichkeit beim Essen (Nahrungsaustritt aus Mund und Nase oder ständiges Verschlucken).
Es gibt in jeder Schluckphase (präoral, oral, pharyngeal und ösophageal) therapeutische Interventionsmöglichkeiten durch die Sprach- und Schlucktherapie. Ziele sind zunächst die Wiederherstellung der intraoralen Sensibilität und der Aufbau der Schutzreflexe z.B Würgereflex. Das Spektrum reicht von motorischen Übungen einzelner Muskelpartien, Massagen, thermischer Stimulation über Veränderungen der Körperhaltung beim Essen (z. B. durch Änderung der Kopfposition) bis zu Veränderungen der Nahrungskonsistenzen (z. B. Pürrieren der Speisen oder Andicken von Flüssigkeiten). Vorübergehend muss der Patient meist mittels Magensonde oder intravenös ernährt werden.
Der ungestörte Schluckvorgang ermöglicht die neben lebenserhaltender Flüssigkeits- und Nahrungsaufnahme auch das Erleben von Genuss und Wohlbefinden. Daher bedürfen Schluckstörungen immer einer genaueren Abklärung. Dazu sollte neben einer klinischen Abklärung mit Mundinspektion, Prüfung der Beweglichkeit im Rachenraum oder der Überprüfung der Reflexe auch eine psychosomatische Abklärung in Betrachtung gezogen werden, sofern die Beschwerden nicht anders einwandfrei erklärt werden können.
Unter einer Stimmbandlähmung (Recurrensparese) versteht man die Lähmung des Nervus recurrens (geht aus dem n.vagus hervor). Seinen Namen hat der Nervus recurrens durch seinen Verlauf bekommen. Am Kehlkopf innerviert der n.recurrens den Muskel, der die beiden Stimmbänder öffnet. Er ist aber auch für den gerichteten Schluss der beiden Stimmlippen zuständig.
Die Ursachen für eine Stimmbandlähmung sind vielfältig. Im Prinzip kann der Nerv an jeder Stelle seines Verlaufs geschädigt werden, z.B während einer in Zusammenhang mit der NF2 erforderlichen Operation. Dank neuartiger Behandlungsmethoden, bei denen der Nerv während einer Operation sichtbar gemacht werden kann, ist eine N. recurrens Verletzung unter der Operation erheblich seltener geworden. Eine psychische Komponente spielt bei einer Vielzahl von funktionellen und sogar organischen Dysphonien eine Rolle.
Um die Folgen einer Stimmbandlähmung zu verstehen, muss man die Funktion der beiden Stimmbänder oder Stimmlippen kennen. Für eine klare Stimme (ohne Heiserkeit) ist es notwendig, dass die beiden Stimmlippen sich bis auf wenige Millimeter annähern. Für die ungestörte Atmung müssen sich die Stimmlippen dagegen möglichst weit voneinander entfernen, um genug Luft zwischendurch zu lassen.
Der Nerv kann aber nicht nur in der Peripherie geschädigt werden. Blutungen im Gehirn oder ein Schlaganfall können das Ursprungsgebiet des Nervs betreffen. Hier spricht man dann von einer zentralen Recurrensparese. Neben den möglichen körperlichen Ursachen, die eine Lähmung des Nervs bedingen, kann auch durch die Psyche eine Lähmung hervorgerufen werden. Diese Patienten erkennt man daran, dass sie mit einer sehr heiseren Stimme sprechen, aber laut Husten können.
Symptome
Die Symptomatik einer Stimmlippenlähmung ist abhängig von der Stellung des gelähmten Stimmbandes, vom Kompensationsgrad (z. B. durch Überfunktion des anderen Stimmbandes) und davon, ob nur ein Stimmband oder beide Stimmbänder von der Lähmung betroffen sind. Grundsätzlich unterscheidet man zwischen einseitiger und doppelseitiger Stimmbandlähmung.
Die Symptome einer Recurrensparese hängen davon ab, ob nur ein Nerv oder beide betroffen sind. Man unterscheidet eine einseitige von einer doppelseitigen Stimmbandlähmung. Außerdem macht es einen Unterschied, ob der Nerv lediglich gereizt oder entzündet ist oder ob er im Rahmen einer Operation durchtrennt wurde. Bei der einseitigen Stimmbandlähmung steht die Heiserkeit (Dysphonie) als Symptom im Vordergrund, weil die betroffene Stimmlippe nicht in der Lage ist, sich während der Stimmbildung an die gesunde Stimmlippe anzunähern, und ein Spalt verbleibt. Durch diesen entweicht Luft und die Stimme klingt heiser. Beim Atmen bewegt sich die gesunde Stimmlippe ausreichend weit nach außen, so dass die Stimmritze weit wird. Eine Atemnot besteht in der Regel deshalb nicht. Bei einer lateralen (weiten) Lähmung ist die Stimmritze weiter offen und man bekommt gut Luft, hat jedoch meist eine schlechte Stimme. Die Qualität der Stimmbildung hängt davon ab, wie weit sich die beiden Stimmlippen aneinander annähern können. Die Atmung ist bei einer einseitigen Stimmbandlähmung nur wenig beeinträchtigt.
Die Stimme nämlich wird von den beiden im Kehlkopf von vorne nach hinten gespannten Stimmbändern/Stimmlippen gebildet. Unterhalb des Kehlkopfes schließt sich die Luftröhre an, die zur Lunge führt.

Alle Atemluft fließt an den Stimmbändern vorbei. Für die Funktion des Atmens stehen die Stimmbänder geöffnet, so dass die Luft ungehindert zwischen den beiden Stimmbändern ein- und ausströmen kann.
Soll aber die Stimme zum Einsatz kommen, nähern sich die beiden Stimmbänder aneinander an, und es kommt zum Stimmbandschluss. Die für die Stimmgebung nötige Ausatemluft bläst nun von unten an die Stimmbänder an. Diese beginnen durch den Anblasedruck zu vibrieren, zu schwingen. So entsteht der Klang, der durch unterschiedliche Spannungsverhältnisse in den einzelnen Kehlkopfmuskeln sowie durch die variierenden Einstellungen von Mund- und Rachenraum, Zunge und Lippen zu höheren und tieferen Tönen und zu den zahlreichen Sprachlauten geformt wird.
Anfangs ist der/die Betroffene deutlich irritiert, weil die Stimme nicht laut werden kann, weil sie stark verhaucht oder auch rau klingt und jede Stimmanstrengung zur deutlichen Tonüberhöhung und zum Wegbrechen führt. Man muss sich auf die eingeschränkte Stimmleistung einstellen und sein Sprechverhalten danach richten. So ist Sprechen gegen Lärm zwecklos, ebenso dass Bemühen um Lautheit. Schnelles, hastiges Sprechen führt zu Atemlosigkeit, zu hohe Stimmlage zum Wegbleiben der Stimme. Angestrengtes Sprechen führt letztlich zu Missempfindungen im Kehlkopfbereich.
Bei der beidseitigen Stimmbandlähmung richten sich die Symptome danach ob die Stimmlippen eng oder weit unbeweglich stehen. Sind sie in einer Mittelstellung und einander sehr weit angenähert, wie es bei der Stimmbildung normalerweise der Fall ist. Weichen sie während der Atmung weichen nicht auseinander, so dass bleibt die Stimmritze eng. Aus diesem Grund stehen bei dieser Form der Lähmung Atemprobleme in verschiedener Ausprägung im Vordergrund. In diesem Fall ist die Stimme meist besser als bei der einseitigen Lähmung. Charakteristisch ist die Atemnot verbunden mit einem hörbaren Atemgeräusch bei der Einatmung. Stehen die Stimmlippen dagegen weiter auseinander, ist die Stimmbildung ebenfalls beeinträchtigt.
Tritt diese Art der beidseitigen Stimmbandlähmung akut auf, kann eine Atemnot gefährlichen Ausmaßes entstehen. In diesem Fall ist rasches Handeln notwendig. Um den Patienten vor dem Ersticken zu schützen, kann der Arzt eine Tracheotomie durchführen. Dabei wird die Luftröhre einige Zentimeter unterhalb der Stimmlippen durchtrennt. Es entsteht hierbei eine Verbindung zwischen der Luftröhre unter der Umwelt unter Umgehung der Stimmbänder und des Hals-Nasen-Rachenraumes. Der Patient kann durch diese Verbindung atmen. Eine Tracheotomie ist eine Notfall- und keinesfalls eine Dauerlösung.
Sind außer dem Nervus recurrens noch andere Nerven, welche den Kehlkopf oder Rachen versorgen, von der Lähmung betroffen, kann es zusätzlich zu Schluckstörungen (Dysphagie) sowie zum Eindringen von Nahrung oder Speichel in die Luftröhre (Aspiration) kommen.
Diagnose
Im Rahmen der Diagnose einer Stimmbandlähmung kann der Arzt sich Mittels eines Laryngoskopes die Stimmlippen direkt ansehen. Dieses Laryngoskop wird durch den Mund in den Rachen eingeführt. Während der Untersuchung und Betrachtung der Stimmbänder wird der Patient dazu aufgefordert, unterschiedliche Laute abzugeben. Im Normalfall werden hierdurch die Stimmbänder bewegt und der Arzt erkennt so mögliche Lähmungen. Differenzialdiagnostisch müssen bei einer Recurrensparese alle Krankheiten ausgeschlossen werden, die eine Heiserkeit oder Luftnot verursachen, ohne dass der Nerv geschädigt ist.
Therapie
Die Therapie der Stimmbandlähmung sollte zuerst die Behandlung der auslösenden Erkrankungen beinhalten. Kann keine Ursache für die Lähmung gefunden werden oder die Ursache nicht behoben werden, richtet sich die Therapie danach, ob beide oder nur eine Stimmlippe betroffen ist. Ist nur eine Stimmlippe betroffen, liegt das Problem darin, dass diese Stimmlippe der gesunden Stimmlippe nur unzureichend angenähert werden kann. Es resultiert eine zu große Stimmritze die bei der Phonation zu viel Luft durchlässt. Um die gelähmte Stimmlippe der gesunden anzunähern, wird zu nächst konservativ (ohne Operation) therapiert. Durch logopädische Stimmübungen ist es möglich, das Stimmband so weit zu trainieren, dass es sich der anderen Seite ausreichend annähern kann. Eine konservative logopädische Therapie sollte mindestens 6 Monate durchgeführt werden.
Stellt sich nach 6-9 Monaten kein Therapieerfolg ein, kann operiert werden. Ziel einer stimmverbessernden Operation ist es, das Stimmband so zu unterfüttern, so dass die für die Phonation benötigte Stimmritze möglichst eng werden kann, bzw. an die gesunde Stimmlippe anzunähern, um das unkontrollierte Entweichen von Luft durch die Stimmritze zu minimieren und somit die Heiserkeit zu vermindern. Der Vorteil dieser Methode besteht in der relativ einfachen Durchführbarkeit in einer kurzen Narkose ohne äußere Narben zu hinterlassen.
Bei einer kehlkopferweiternden Operation dagegen steht die Sicherung der Atmung durch eine Erweiterung der Stimmritze im Vordergrund. Sämtliche kehlkopferweiternden Operationen verbessern die Atmung, verschlechtern jedoch die Stimme. Die Stimmbänder werden bei einer solchen Operation auseinander gezogen und in dieser Stellung fixiert. Der Mediziner spricht bei dieser Methode von einer Lateralfixation.
Die Operationsmethoden unterscheiden sich dahingehend, welches Material zur Unterfütterung des erkrankten Stimmbandes verwendet wird. Da das verwendete Material meist über Monate hinweg vom Körper abgebaut wird, werden dann weitere Operationen notwendig. Weitere Möglichkeiten liegen in der Verlagerung der betroffenen Stimmlippe durch einen Zugang von außen, (wobei entweder körpereigenes Material wie Knorpel oder Fremdmaterial implantiert werden kann) oder in der Verkleinerung der Stimmlippen mittels eines Laserbehandlung.

Therapie nach Rückenmarkstumoren
Ein zentrales Element der postoperativen Nachversorgung und der Rehabilitation ist die krankengymnastische Behandlung. Um Patienten im neurologischen Bereich vor allem nach einer Rückenmark OP spezifischer und effektiver therapieren zu können, arbeiten wir nach dem Bobath - Konzept.
Was ist das Bobath-Konzept?
ein 24-Stunden-Management, d.h. Ärzte, Physiotherapeuten, Ergotherapeuten, Pflege, Patient und seine Angehörigen werden mit in die Betreuung und Therapie einbezogen.
Was ist das Bobath-Ziel?
- die Selbständigkeit von harmonischen Bewegungsabläufen im Alltag des Patienten wieder herzustellen.
- das 24- Stunden Konzept ist die philosophische Grundlage für eine optimale Rehabilitation des Patienten durch neuronales Lernen
- die vorhandenen Ressourcen des Patienten zu fördern
Der entscheidende Faktor für den Rehabilitationserfolg ist die ganzheitliche Behandlung des Patienten, d.h. den Patienten individuell mit all seinen Bedürfnissen und Problemen wahrzunehmen. Durch professionelle Hilfestellungen, Hilfsmittel und ein gezieltes Selbsthilfetraining sollen die Patienten lernen, die Anforderungen und Aktivitäten des täglichen Lebens wieder selbst zu bestimmen.
Nach einer OP von Rückenmarkstumoren können motorische Störungen der Bewegungsabläufe, sowie die Sensibilität des Patienten auftreten, aber auch spastische Lähmungen und schmerzhafte so genannte spinalen Automatismen können vorkommen. Das Ziel der Physiotherapie ist es, den Patienten mit all seinen Begleiterscheinungen mit Hilfe der Therapie und Hilfsmitteln schmerzfrei zu bekommen und Ihn möglichst schnell wieder auf die Selbständigkeit im Alltag vorzubereiten.
Mit Hilfe z. B. des Stehtrainers kann der Patient sofort in die Standphase gebracht werden, auch wenn er selbst nicht genug Kraft in den Beinen hat. Indikation bei diesem Gerät ist die Vorbeugung von Osteoporose, Kreislaufstabilisierung und die Psyche des Patienten aufrecht zu erhalten. Der Stehtrainer gibt dem Therapeuten die Möglichkeit mit dem Patienten Haltungsübungen auszuführen und zu üben.
Welche Hilfsmittel jeweils zum Einsatz kommen, hängt von den Fähigkeiten und der muskulären Versorgung des Patienten ab. Das Ziel ist ein möglichst physiologisches und ökonomisches Gangbild bei minimalen Hilfsmitteleinsatz zu erreichen.
Genauso das Neuromedizinische Gerät, es bewegt dem Patient die Gelenke, um Kontrakturen vorzubeugen; spastische Zustände können hiermit gelöst werden.
Atemtherapie
Auch Atemtherapie sollte durchgeführt werden, da durch die schlechte Haltung des Patienten, es zum Verlust der Thoraxmobilität kommt - d.h. der Tonus der Atemhilfsmuskulatur steigt an und es treten Verspannungen auf. Des weiteren verringern sich die Vitalkapazität und das Atemzugvolumen des Patienten. Als Folge kommt es zu einer geringen Sauerstoffsättigung im Blut, dadurch ermüdet der Patient schneller und sein Kreislauf wird negativ beeinflusst. Die Atemtherapie beugt auch einer Lungenentzündung vor.
Passive/aktive Bewegungsübungen
Die passiven/aktiven Bewegungsübungen sollen Gelenkkontrakturen verhindern und die geschwächten Muskelgruppen kräftigen.
Manuelle Lymphdrainage
Begleiterscheinungen wie Ödeme werden durch die Lymphdrainage verringert.
Thermische Anwendungen. z.B. Eisanwendungen werden bei Sensibilitätsstörungen eingesetzt, um die betroffene Seite des Patienten auf die Therapie vorzubereiten und zu stimulieren.
Bindegewebsbehandlung
Bindegewebsbehandlungen werden bei Muskelverspannungen und Verklebungen eingesetzt.
Lagerung
Die Lagerung soll die Dehnung und Wahrnehmung der betroffenen Seite des Patienten trainieren, des weiteren sollte der Patient alle 2-3 Stunden umgelagert werden zur Dekubitusphrophylaxe, wenn er selbst nicht in der Lage dazu ist, sich zu wenden.
Gangschule
Das Gehtraining ist das eigentliche Ziel der Rehabilitation bei nicht kompletten Querschnittpatienten, da Sie zur Selbständigkeit motiviert werden. Sinn der Gangschule ist, im ZNS gespeicherte Bewegungsabläufe wieder abzurufen. Für die Gangschule steht als Voraussetzung, dass der Patient einen stabilen Kreislauf hat, dann kann diese Therapie auf einem Laufband durchgeführt werden.
Beim Gehtraining kann man eine Ganganalyse durchführen, um Gangfehler oder Veränderungen im Gangbild festzustellen.
Elektrotherapie
Elektrotherapie kommt im Rahmen einer Schmerzbehandlung oder zur Muskelstimulation zum Einsatz.

Helfen • Spenden • Mitmachen
Unterstützen Sie unsere Arbeit.
Wir bringen Menschen mit gleichen Anliegen zusammen. Der rege Austausch untereinander schafft den Weg aus der Isolation, hilft, eine neue Normalität im Umgang mit der Krankheit und neue Lebensqualität zu entwickeln.
Angebote wie das Jugendcamp, Eltern-Kind-Seminare, Seminare für Erwachsene, das Mücketreffen, Online-Treffen und vieles mehr bieten dazu effektive Möglichkeiten.

